
【题目】一种从废甲醇催化剂(含ZnO、CuO及少量Fe2O3、石墨及MnO2等)回收铜并制取活性氧化锌的工艺流程如下:

回答下列问题:
(1)废催化剂“破碎”的目的是________,“酸浸”后“浸渣”的主要成分是________。
(2)“氧化”时Mn2+被氧化的离子方程式为________。
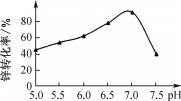
(3)“中和沉淀”时pH对锌转化为碱式碳酸锌的转化率影响如图所示:pH>7时,转化率开始减小的原因是________[用离子方程式说明,已知Zn(OH)2性质与Al(OH)3类似]。
(4)“过滤3、洗涤”时,能证明已洗涤干净的操作方法是________;所得滤液中主要溶质是________。
(5)测定“粗铜粉”中铜的质量分数的实验步骤如下:
Ⅰ.准确称取粗铜粉mg,加入足量HCl和H2O2使其完全溶解(Cu+H2O2+2H+=Cu2++2H2O,Zn及Fe也同时溶解)。
Ⅱ.将溶液煮沸1~2min,除去过量的H2O2。
Ⅲ.依次滴入适量氨水、醋酸及NH4HF2溶液,以排除Fe3+的干扰。然后加入稍过量的KI(2Cu2++4I-=2CuI↓+I2),再加入1mL淀粉溶液作指示剂,用cmol·L-1Na2S2O3标准溶液滴定至蓝色消失(I2+2S2O32-=2I-+S4O62-)且半分钟内不变色,共消耗Na2S2O3标准溶液VmL。
①铜的质量分数为________(列出计算表达式)。
②缺少步骤Ⅱ会使测定的铜的质量分数________(填“偏大”“偏小”或“不变”)。
【答案】提高铜、锌的浸取率和浸取速率 石墨 Mn2++S2O82-+3H2O=MnO(OH)2↓+2SO42-+4H+ Zn2++4OH-=ZnO22-+2H2O 取少量最后一次的洗涤液于试管中,向其中滴加盐酸酸化的BaCl2溶液,若不产生白色沉淀,则表明已洗涤干净 (NH4)2SO4 ![]() 偏大
偏大
【解析】
滴定实验计算思路:先找出所求物质与标准溶液的物质的量关系式:2Cu2+~ I2~2S2O32-,进而求出Cu的质量,最后算出其质量分数。
(1)“破碎”的目的是增大固体接触面积,提高铜、锌的浸取率和浸取速率;石墨常温下不与浓硫酸反应,所以“酸浸”后“浸渣”的主要成分是石墨;
(2)“氧化”时,Mn2+被氧化为MnO(OH)2,S2O82-中-1价的氧原子被还原为-2价,所以离子方程式为Mn2++S2O82-+3H2O=MnO(OH)2↓+2SO42-+4H+;
(3)已知Zn(OH)2性质与Al(OH)3类似,即碱性过强,Zn(OH)2会与OH-反应生成ZnO22-,故pH>7时,转化率开始减小的原因用离子方程式说明是Zn2++4OH-=+2H2O;
(4)证明沉淀已洗涤干净的操作方法是检验杂质离子:硫酸根离子,步骤是取少量最后一次的洗涤液于试管中,向其中滴加盐酸酸化的BaCl2溶液,若不产生白色沉淀,则表明已洗涤干净;由溶液中剩余大量NH4+和SO42-可知,所得滤液中主要溶质是(NH4)2SO4;
(5)①由关系式:2Cu2+~ I2~2S2O32-可知,n(Cu2+)= n(S2O32-)=cV![]() 10-3mol,
10-3mol,
m(Cu2+)=![]() 10-3 g,则铜的质量分数为
10-3 g,则铜的质量分数为![]() 。
。
②缺少步骤Ⅱ,过量的H2O2会氧化更多I-,生成更多的I2,消耗更多的S2O32-,使测定的铜的质量分数偏大。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,下列溶液的离子浓度关系式正确的是
A. pH=5的H2S溶液中,c(H+)= c(HS-)=1×10—5mol·L—1
B. pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C. pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+ c(H+)= c(OH-)+c( HC2O4-)
D. pH相同的①CH3COO Na②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知:
N2(g) + 2O2(g) =2 NO2(g) ΔH = +67.7kJ/mol
2N2H4(g) + 2NO2(g) =3N2(g) + 4H2O (g) ΔH = -1135.7kJ/mol
下列说法正确的是
A. N2H4(g) + O2(g) = N2(g) + 2H2O(g) ΔH = -1068 kJ/mol
B. 铂做电极,以KOH溶液为电解质的肼——空气燃料电池,放电时的负极反应式:N2H4 -4e- + 4OH- = N2 + 4H2O
C. 肼是与氨类似的弱碱,它易溶于水,其电离方程式:N2H4 + H2O![]() N2H5+ + OH-
N2H5+ + OH-
D. 2NO2![]() N2O4,加压时颜色加深,可以用勒夏特列原理解释
N2O4,加压时颜色加深,可以用勒夏特列原理解释
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列填空。
(1)按以下实验方案可从海洋物质样品中提取具有抗肿瘤活性的天然产物。

则(1)、(2)、(3)、(4)的分离提纯方法依次为________、________、________、________。
(2)以下分离提纯方法不正确的是______(填字母)
A | B | C | D |
除去硝酸钾中混有的氯化钠 | 从溴单质的四氯化碳 溶液中提取出Br2 | 四氯化碳和水的分离 | 用自来水制取蒸馏水 |
重结晶 | 萃取 | 蒸馏 | 蒸馏 |
(3)下列物质保存方法正确的是______(填字母)
A | B | C | D |
|
|
|
|
(④) | (⑤) | (②⑥) | ( ①③) |
①NaOH溶液 ②浓硫酸 ③Na2CO3溶液 ④白磷 ⑤硝酸银溶液 ⑥酒精
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼、铝、镓、铟、铊是第ⅢA族元素,它们在工农业生产中应用非常广泛。
(1)基态硼原子的核外电子排布图为______________________。
(2)I1(Mg)___________I1(Al)(填“大于”或“小于”),其原因是______________________。
(3)三氯化铝加热到177.8℃时,会升华为气态二聚氯化铝(Al2Cl6,其中铝原子和氯原子均达8电子稳定结构),请写出二聚氯化铝(Al2Ci6)的结构式:______________________,其中铝原子轨道采用___________杂化。
(4)BF4-的空间构型为___________,与BF4-互为等电子体的分子是___________ (写化学式,任写一种即可)。
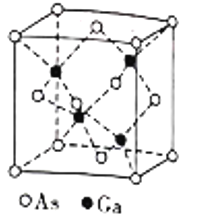
(5)镓(Ga)可与砷(As)形成砷化(GaAs)晶体,该晶体的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示。该晶体的类型为________________。Ga和As的摩尔质量分别为MGag·mol-1和MAsg·mol-1,阿伏加德罗常数值为NA,则晶胞中Ca与As原子的核间距为___________pm。(列出字母表达式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】aLCO和O2的混合气体,点燃后得到bL 气体(前后条件相同),则混和气体中CO的体积可能是下列组合中的( )
①b ②![]() a ③a-b ④a+b ⑤2(a-b)
a ③a-b ④a+b ⑤2(a-b)
A. ①②③B. ②④⑤C. ①③④D. ①②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在环保、化工行业有一种溶液浓度的表示方法:质量—体积浓度,用单位体积溶液中所含的溶质质量来表示,单位g·m-3或g·L-1。现有一种20 ℃时的饱和CuSO4溶液,密度为1.2 g·cm-3,质量—体积浓度为200 g·L-1,则对此溶液的说法不正确的是( )
A. 该溶液的质量分数为16.7%
B. 该溶液的物质的量浓度为1.25 mol·L-1
C. 在20 ℃时,硫酸铜的溶解度为20 g
D. 在20 ℃时把200 g CuSO4·5H2O溶解于1 L水中恰好得到饱和溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,CaSO4在水中的沉淀溶解平衡曲线如图所示。下列判断正确的是
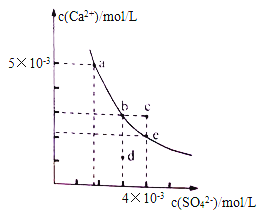
A. 曲线上任意一点的Ksp都相同
B. 在CaSO4饱和溶液中加入Na2SO4固体,可使溶液由b点变化到c点
C. 蒸发水后,可使溶液由d点变化到b点
D. 常温下,CaSO4的Ksp的数量级为10-5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粗盐中常含有少量的泥沙及氯化钙、氯化镁、硫酸盐等一些可溶性的杂质。粗盐的提纯实验操作步骤如图所示:
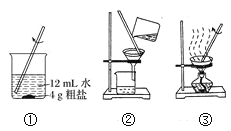
(1)请写出图中各步实验操作的名称②_____,③______。
(2)实验操作②的主要目的是______。
(3)实验操作①②③中都使用的仪器是_____,它在③中其作用是_____。
(4)通过上述实验操作,得到的精盐中可能含有的杂质是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com