
| A.加稀盐酸 | B.加NaOH溶液 | C.焰色反应 | D.加热 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
| A.铝粉中混有镁粉:加足量的氢氧化钠溶液,然后过滤即可 |
| B.氯气中混有氯化氢:用饱和食盐水洗气 |
| C.自来水中混有少量Fe3+:采用蒸馏方法 |
| D.固体MnO2中混有KCl:加水,然后过滤 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
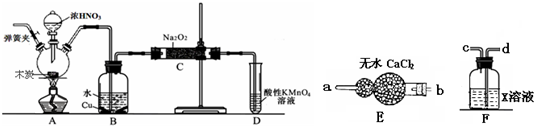
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 编号 | 实验操作 | 预期现象和结论 |
| ① | ______ | ______ |
| ② | ______ | ______ |
| ③ | ______ | ______ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
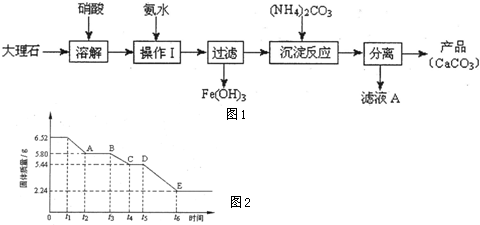
| ||
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.检验某溶液中是否含有SO42-,通常是先向试液中滴加BaCl2溶液,然后再滴加稀盐酸 |
| B.向某溶液中滴加稀氢氧化钠溶液,若未嗅到氨的气味,则说明该溶液中无铵盐 |
| C.某白色固体与强酸溶液接触产生大量无色气体,则该固体一定是碳酸钙 |
| D.检验某溶液中是否含有Fe3+,通常是向试液中滴加KSCN溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

| 物质 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 293K溶解度(g) | 111 | 33.7 | 11.1 | 217 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com