
 25℃时,用浓度为0.1000mol•L-1的NaOH溶液滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ滴定曲线如图所示.下列说法正确的是( )
25℃时,用浓度为0.1000mol•L-1的NaOH溶液滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ滴定曲线如图所示.下列说法正确的是( )| A. | 根据滴定曲线,可得Ka(HY)≈10-9 | |
| B. | 在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX | |
| C. | HY与HZ混合,达到平衡时:c(H+)=$\frac{Ka(HY)•c(HY)}{c({Y}^{-})}$+c(Z-)+c(OH-) | |
| D. | 将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(Na+)>c(Y-)>c(X-)>c(OH-)>c(H+) |
分析 A.根据氢氧化钠滴到10mL,c(HY)≈c(Y-),Ka(HY)≈c(H+);
B.根据图象分析,0.1000mol•L-1的三种酸HX、HY、HZ的pH分别为4、3、1;
C.溶液中满足电荷守恒c(H+)=c(Y-)+c(Z-)+c(OH-),再结合HY的电离平衡常数分析;
D.HX恰好完全反应时,HY早已经反应完毕,溶质为NaX和NaY;由于酸性HX<HY,则NaY水解程度小于NaX,溶液中c(X-)<c(Y-).
解答 解:A.当NaOH溶液滴到10mL时,溶液中c(HY)≈c(Y-),即Ka(HY)≈c(H+)=10-pH=10-5,故A错误;
B.氢氧化钠体积为0时,0.1000mol•L-1的三种酸HX、HY、HZ的pH分别为4、3、1,故酸性大小为HX<HY<HZ,故导电性HZ>HY>HX,故A错误;
C.HY与HZ混合,溶液中电荷守恒为c(H+)=c(Y-)+c(Z-)+c(OH-),再根据HY的电离平衡常数可知:,c(H+)=$\frac{Ka(HY)•c(HY)}{c({Y}^{-})}$≠c(Y-),故C错误;
D.HX恰好完全反应时,HY早已经完全反应,所得溶液为NaX和NaY混合液,Y-、X-在溶液中水解溶液稀释碱性:c(OH-)>c(H+);酸性HX<HY,NaY水解程度小于NaX,故溶液中c(X-)<c(Y-),溶液中离子浓度大小为:c(Na+)>c(Y-)>c(X-)>c(OH-)>c(H+),故D正确;
故选D.
点评 本题考查了溶液酸碱性与溶液pH的计算、酸碱混合的定性判断、溶液中离子浓度大小比较,题目难度中等,注意掌握酸碱混合的定性判断及有关溶液pH的计算方法,正确分析、理解图象信息为解答本题的关键,要求学生能够根据电荷守恒、物料守恒及盐的水解原理比较溶液中各离子浓度大小.


科目:高中化学 来源: 题型:多选题

| A. | n=0.02 | |
| B. | y=2240 | |
| C. | 原混合物中FeS04的质量分数约为89% | |
| D. | m=3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
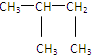 ⑩
⑩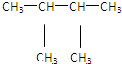 ⑪${\;}_{17}^{35}$Cl⑫
⑪${\;}_{17}^{35}$Cl⑫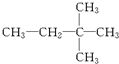
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.2 L | B. | 6.27 L | C. | 5.6 L | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(碱)=10V(酸) | B. | V(酸)=10V(碱) | C. | V(酸)=2V(碱) | D. | V(酸)=V(碱) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com