
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:解答题
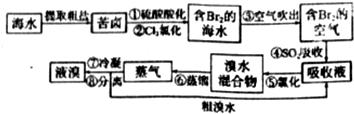
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:
中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | 3.4 |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .氟元素最低负化合价为-1 价.
.氟元素最低负化合价为-1 价. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴化钠只有一部分反应,氟化钠未反应 | |
| B. | 氟化银溶于水 | |
| C. | 沉淀是氟化银 | |
| D. | 沉淀是氟化银与溴化银的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
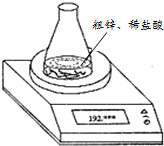 实验室制取氢气所用粗锌中多含有杂质铜,某小组同学利用如图装置测定粗锌中锌的质量分数,每隔相同时间读得电子天平的数据如表:(已知粗锌质量为1.950g、锥形瓶和稀盐酸的质量为190.720g)
实验室制取氢气所用粗锌中多含有杂质铜,某小组同学利用如图装置测定粗锌中锌的质量分数,每隔相同时间读得电子天平的数据如表:(已知粗锌质量为1.950g、锥形瓶和稀盐酸的质量为190.720g)| 读数次数 | 质量(g) | |
| 锥形瓶 + 稀盐酸 + 粗锌 | 第1次 | 192.655 |
| 第2次 | 192.636 | |
| 第3次 | 192.620 | |
| 第4次 | 192.610 | |
| 第5次 | 192.610 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Al3+、Cl-、OH- | B. | Na+、H+、OH-、Cl- | ||
| C. | NH4+、Mg2+、SO42-、Cl- | D. | Na+、Cl-、AlO2-、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属原子半径都较大,最外层电子数较少 | |
| B. | 金属受外力作用时,层间彼此滑动,但金属离子与自由电子仍保持其较强的作用 | |
| C. | 金属中的大量自由电子,受外力作用时,运动速度加快 | |
| D. | 自由电子能迅速传递能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com