
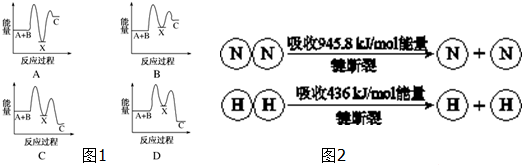
分析 (1)根据物质具有的能量进行计算:△H=E(生成物的总能量)-E(反应物的总能量),当反应物的总能量大于生成物的总能量时,反应放热,当反应物的总能量小于生成物的总能量时,反应吸热,以此解答该题;
(2)①依据热化学方程式的书写方法分析书写;
②依据反应焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量计算得到.
解答 解:(1)由反应 A+B→C(△H<0)分两步进行 ①A+B→X (△H>0)②X→C(△H<0)可以看出,A+B→C(△H<0)是放热反应,A和B的能量之和大于C,由①A+B→X (△H>0)可知这步反应是吸热反应,X→C(△H<0)是放热反应,故X的能量大于A+B;A+B的能量大于C;X 的能量大于C,图象D符合,
故选D;
(2)(1)①合成塔中每生成2mol NH3,放出92.2kJ热量,依据热化学方程式写出,标注物质聚集状态和对应反应放出的热量写出热化学方程式为:N2(g)+3H2(g)=2NH3(g)△H=-92.2kJ/mol
故答案为:N2(g)+3H2(g)=2NH3(g)△H=-92.2kJ/mol;
②3H2+N2?2NH3,反应焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量=3×436+945.8-6×N-H键键能=-92.2,N-H键键能=391kJ,
故答案为:391.
点评 本题为图象题,主要考查了物质的能量分析应用,化学反应的能量变化、分析,题目难度不大,注意反应热与物质总能量大小的关系判断.


科目:高中化学 来源: 题型:选择题
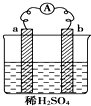
| A. | 反应后a极质量减小 | |
| B. | 碳棒上有气体逸出 | |
| C. | 导线上有电流,电子流动方向从a→b | |
| D. | a极上发生还原反应,b极上发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
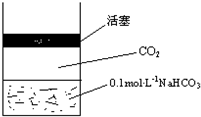 在常温下,碳酸的电离常数Ka1=4.3×10-7、Ka2=5.6×10-11,如图所示的装置中,若活塞下移,下列说法不正确的是( )
在常温下,碳酸的电离常数Ka1=4.3×10-7、Ka2=5.6×10-11,如图所示的装置中,若活塞下移,下列说法不正确的是( )| A. | 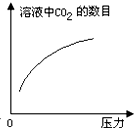 | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两个反应都是氧化还原反应 | |
| B. | 两个反应都是置换反应 | |
| C. | 两个反应都有化学能与热能之间的转化 | |
| D. | 反应(2)是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生铁中含有碳,抗腐蚀能力比纯铁弱 | |
| B. | 用锡焊接的铁质器件,焊接处易生锈 | |
| C. | 在铁制品上镀铜时,镀件(待镀金属)为阳极,铜盐为电镀液 | |
| D. | 铁制钥匙表面镀上一层锌,钥匙不易被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 代号 | 物质 | 结构式 | 水中溶解度/g(25℃) | 熔点/℃ |
| A | 邻-硝基苯酚 | 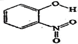 | 0.2 | 45 |
| B | 对-硝基苯酚 | 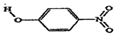 | 1.7 | 114 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com