
【题目】人体内所含微量元素是指总含量不到万分之一,而质量总和不到人体质量的千分之一的16种元素,这些元素对人体正常新陈代谢和健康起着重要作用.下列元素肯定不属于人体内微量元素的是( )
A.Zn
B.H
C.Fe
D.Cu
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】铜的氯化物是重要的化工原料,广泛地用作有机合成催化剂.
实验室中以粗铜(含杂质Fe)为原料,某种制备铜的氯化物的流程如图1.
按要求回答下列问题:
(1)在进行操作①之前,要确认溶液中杂质已经完全沉淀,检验的具体操作和现象是 .
(2)上述流程中,所得固体1需要加稀盐酸溶解,其理由是;
(3)溶液1可加试剂X用于调节pH以除去杂质,X可选用下列试剂中的(填序号) .
a.NaHCO3 b.NH3H2O c.CuO d.Cu2(OH)2CO3
(4)现用如图2所示的实验仪器及药品来制备纯净、干燥的氯气并与粗铜反应(铁架台、铁夹省略).
①按气流方向连接各仪器接口顺序是:a→、→、→f、g→ .
②为了防止生成氧化铜,实验时在大试管加热前要进行一步重要操作,其操作是 .
③实验过程中,饱和食盐水中出现少许浑浊的现象,请用化学相关原理和知识解释原因:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮族元素化合物在医药、纳米材料制备中应用广泛.
(1)P元素的基态电子电子排布式为
(2)白磷的分子式为P4 , 其结构如图1所示,科学家目前合成了 N4分子,N 原子的杂化轨道类型是 , N﹣N﹣N 键的键角为; 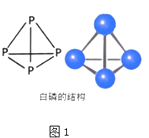
(3)N、P、As原子的第一电离能由大到小的顺序为 .
(4)HNO3、HNO2是氮元素形成的含氧酸,酸性较强的是 , 酸根中没有孤对电子的是 , NO2﹣价电子构型是 .
(5)立方氮化硼晶体的结构如图2所示:N与As是同族元素,B与Ga是同族元素,立方砷化镓晶体与立方氮化硼晶体结构类似,两种晶体中熔点较高的是;立方砷化镓晶体的晶胞边长为a pm,则其密度为gcm﹣3(用含a的式子表示,设NA为阿伏伽德罗常数的值). 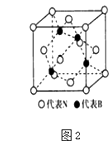
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅是信息高速公路的基石,通常以硅石(SiO2>99.0%、还有少量的Al2O3、Fe2O3等)为主要原料制备,主要流程如图所示. 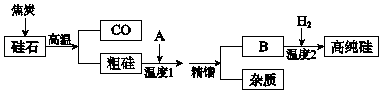
(1)从硅石中得到粗硅的化学方程式是 , 粗硅含有的杂质有铝、等.
(2)二氧化硅与焦炭在高温下也能得到一种硬度仅次于金刚石的物质金刚砂(化学式为SiC,Si为+4价),原理是SiO2+3C ![]() SiC+2CO↑,该反应中的氧化剂是 .
SiC+2CO↑,该反应中的氧化剂是 .
(3)若A是氯气,B是四氯化硅,精馏得到纯净SiCl4 , 温度应控制的范围是(填序号).
物质 | SiCl4 | SiHCl3 | FeCl3 | AlCl3 |
熔点/℃ | ﹣70 | ﹣128.2 | 306 | ﹣﹣ |
沸点/℃ | 57.6 | 31.85 | 315 | 181 升华 |
a.55~60℃b.180~200℃c.300~320℃
则精馏分离出的杂质成分是 .
(4)若A是HCl,B是SiHCl3 , 生产过程中可循环利用的物质是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组进行有关Cu、硝酸、硫酸化学性质的实验,实验过程如图所示.下列有关说法正确的是
( )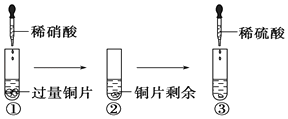
A.①中溶液呈蓝色,试管口有红棕色气体产生,稀硝酸被还原为NO2
B.③中反应的化学方程式:3Cu+Cu(NO3)2+4H2SO4=4CuSO4+2NO↑+4H2O
C.③中滴加稀硫酸,铜片继续溶解,说明稀硫酸的氧化性比稀硝酸强
D.由上述实验可知:Cu在常温下既可与稀硝酸反应,也可与稀硫酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列问题:
(1)羟基的电子式
(2)相对分子质量为72且沸点最高的烷烃的结构简式为
(3)写出方程式:实验室制乙炔 .
(4)写出: ![]() 形成六元环酯的结构简式
形成六元环酯的结构简式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA代表阿伏伽德罗常数,下列说法正确的是( )
A.相同质量的铝,分别与足量的盐酸和氢氧化钠溶液反应放出的氢气体积一定不相同
B.56gFe与足量盐酸反应转移电子数为3NA
C.任何条件下,22.4LNH3与18gH2O所含电子数均为10NA
D.46gNO2和N2O4的混合物含有的原子数为3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com