
分析 浓硝酸受热分解生成二氧化氮与氧气和水,方程式:4HNO3 =4NO2+O2+2H2O,二氧化氮与氧气、水反应生成硝酸,气体减少,试管内压强减小,据此判断现象.
解答 解:浓硝酸受热分解生成二氧化氮与氧气和水,方程式:4HNO3 =4NO2+O2+2H2O,所以将浓硝酸分解的气体收集在一支试管中,再将试管倒插在水中,试管内的二氧化氮与氧气、水反应生成硝酸,化学方程式:4NO2+O2+2H2O=4HNO3 ,导致试管内压强减小,在外界大气压作用下,水被压入试管内,
故答案为:试管内液面上升;NO2和O2的混合气体溶于水使试管内压强减小;4NO2+O2+2H2O=4HNO3 ;
点评 本题考查了浓硝酸的性质,熟悉浓硝酸的不稳定性、二氧化氮的性质是解题关键,题目难度不大.


 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:选择题
| A. | 17.4g | B. | 46.8g | C. | 40.8g | D. | 23.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入银氨溶液,在水浴上加热 | |
| B. | 加入二至三滴紫色石蕊试液 | |
| C. | 先蒸馏,然后对蒸出的物质的水溶液进行银镜反应实验 | |
| D. | 先加入足量的NaOH溶液,然后蒸馏,对蒸出的物质的水溶液进行银镜反应实验 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,CH3CH═CH2$→_{500℃}^{Cl_{2}}$
,CH3CH═CH2$→_{500℃}^{Cl_{2}}$ .以异戊二烯(
.以异戊二烯( 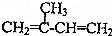 ),丙烯为原料合成
),丙烯为原料合成 .(用反应流程图表示,并注明反应条件)
.(用反应流程图表示,并注明反应条件)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知:
已知:| 药品名称 | 熔点/℃ | 沸点(℃) | 密度g/cm3 | 溶解性 |
| 丁醇 | -89.5 | 117.7 | 0.8098 | 微溶于水、溶于浓硫酸 |
| 1-溴丁烷 | -112.4 | 101.6 | 1.2760 | 不溶于水和浓硫酸 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 资料卡片 | ||
| 物质 | 熔点 | 沸点 |
| SiCl4 | -70℃ | 57.6℃ |
| TiCl4 | -25℃ | 136.5℃ |


查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3mol | B. | 4mol | C. | 5mol | D. | 6mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com