
某温度时,在一个容积为2 L的密闭容器中,X、Y、Z,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白: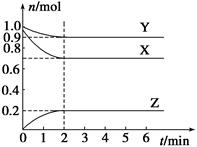
(1)该反应的化学方程式为_______________;
(2)反应开始至2 min,气体Z的反应速率为____________;
(3)若X、Y、Z均为气体,反应达到平衡时:
①压强是开始时的________倍;
②若此时将容器的体积缩小为原来的 0.5倍,达到平衡时,容器内温度将降低(容器不与外界进行热交换),则该反应的正反应为________反应(填“放热”或“吸热”)。
科目:高中化学 来源: 题型:填空题
(1)已知工业上生产H2的过程中有如下反应: CO (g) + H2O (g) CO2(g) + H2 (g)在一定条件下的密闭容器中,该反应达到化学平衡状态。请回答:
CO2(g) + H2 (g)在一定条件下的密闭容器中,该反应达到化学平衡状态。请回答:
①恒容增大H2O (g)的物质的量,则CO的转化率 (填“增大”或“减小”)。
②若升高温度能使化学平衡向正反应方向移动,则正反应是 (填“放热”或“吸热”)反应。
③在某温度时,该反应10 min达到平衡,且有如下数据:
| 浓度 物质 | CO | H2O | CO2 | H2 |
| 起始浓度/(mol·L-1) | 2.0 | x | 0 | 0 |
| 平衡浓度/(mol·L-1) | 0.4 | 6.4 | 1.6 | 1.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
t℃时,将3 mol A和1 mol B气体通人体积为2L的密闭容器中(容积不变),发生如下反应:3A(g)+B(g) xC(g),2min时反应达到平衡状态(温度不变),剩余了0.8 mol B,并测得C的浓度为0.4 mol/L,请填写下列空白:
xC(g),2min时反应达到平衡状态(温度不变),剩余了0.8 mol B,并测得C的浓度为0.4 mol/L,请填写下列空白:
(1)从开始反应至达到平衡状态,生成C的平均反应速率为 ;
(2)x= ;
(3)若向原平衡混合物的容器中再充人a mol C,在t℃时达到新的平衡,此时B的物质的量为n(B)=
mol;
(4)如果上述反应在相同温度和容器中进行,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间应该满足的关系式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在某温度下,体积恒定的密闭容器中加入2 molN2和4 molH2,发生如下反应:
N2(g)+3H2(g) 2NH3(g);ΔH=—92.4 kJ/mol。达到平衡时,放出热量46.2 kJ。求:
2NH3(g);ΔH=—92.4 kJ/mol。达到平衡时,放出热量46.2 kJ。求:
(1)达到平衡时,N2的转化率为_______________, NH3的体积分数为 。
(2)若向该容器中加入a mol N2、b mol H2、c mol NH3,且a、b、c均为正数,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同。a、b、c取值必须满足的一般条件是 , 。
(3)科学家发明了使NH3直接用于燃料电池的方法,其装置用铂黑作电极、加入电解质溶液中,一个电极通入空气,另一电极通入NH3。其电池总反应式为:4NH3+3O2=2N2+6H2O,电解质溶液应显 (填“酸性” 、“中性” 或“碱性” ),写出正极的电极反应方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如图所示,B中活塞可以自由滑动。A、B中均有1mol X、1mol Y,起始时,V(A)=V(B)=a L。关闭K,相同温度下,两容器中同时发生反应:2X(g)+2Y(g) Z(g)+2W(g) ΔH<0,达到平衡(Ⅰ)时,V(B)=0.8a L。
Z(g)+2W(g) ΔH<0,达到平衡(Ⅰ)时,V(B)=0.8a L。
(1)达到平衡所需的时间:A B。(填“>”、“<”、或“=”,下同)
(2)W的百分含量:A B。
(3)B中X的转化率为 。
(4)打开K,重新达平衡(Ⅱ)时,B的体积为 L(用含a的式子表示,连通管体积忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
研究NO2、、CO等大气污染气体的处理具有重要意义。
利用反应6NO2(g)+8NH3(g) 7N2(g)+12 H2O(g)可处理NO2。700℃时,向容积为2L的密闭容器中充入一定量的NO2和NH3, 反应过程中测定的部分数据见下表
7N2(g)+12 H2O(g)可处理NO2。700℃时,向容积为2L的密闭容器中充入一定量的NO2和NH3, 反应过程中测定的部分数据见下表
| 反应时间/min | n(NO2)/mol | n(NH3)/ mol |
| 0 | 1.20 | 1.60 |
| 2 | 0.90 | |
| 4 | | 0.40 |
 CH3OH(g)。200℃时,向在一个带活塞的密闭真空容器中中充入一定量的CO和H2发生上述反应,压缩容器的容积为原来的一半,平衡将 移动(填向左,向右,不);CO的浓度将 (增大,减小,不变)
CH3OH(g)。200℃时,向在一个带活塞的密闭真空容器中中充入一定量的CO和H2发生上述反应,压缩容器的容积为原来的一半,平衡将 移动(填向左,向右,不);CO的浓度将 (增大,减小,不变)查看答案和解析>>
科目:高中化学 来源: 题型:填空题
设反应①Fe(s)+CO2(g) FeO(s)+CO(g)△H=Q1的平衡常数为K1,
FeO(s)+CO(g)△H=Q1的平衡常数为K1,
反应②Fe(s)+H2O(g) FeO(s)+H2(g)△H=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:
FeO(s)+H2(g)△H=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:
| 温度(T) | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
 CO(g)+H2O(g)△H=Q3
CO(g)+H2O(g)△H=Q3查看答案和解析>>
科目:高中化学 来源: 题型:填空题
将等物质的量的A,B混合于2L的密闭容器中,发生反应:3A(g)+B(g) xC(g)+2D(g) ΔH<0经5min后达到平衡,平衡时测得D的浓度为0.5mol/L,C(A):C(B)=1:2,C的平均反应速率为0.05mol/(L·min)
xC(g)+2D(g) ΔH<0经5min后达到平衡,平衡时测得D的浓度为0.5mol/L,C(A):C(B)=1:2,C的平均反应速率为0.05mol/(L·min)
(l)x的值为_______________;
(2)A的平衡浓度____________;
(3)若恒温恒容,则容器中平衡时的压强与起始时的压强比___________;
(4)下图是某一时间段中该反应速率与反应进程的曲线关系图,回答下列问题: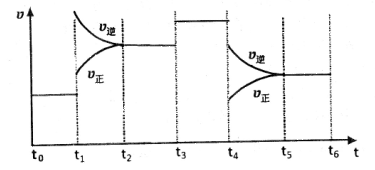
①处于平衡状态的时间段是____________。
② 、
、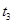 、
、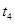 时刻体系中分别是什么条件发生了变化?
时刻体系中分别是什么条件发生了变化? ___________、
___________、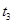 _____________ 、
_____________ 、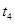 _____________(填A-E)
_____________(填A-E)
A.升温 B.降温 C.加催化剂 D.加压 E.减压
③下列各时间段时,A的体积分数最高的是____
A.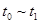 B.
B.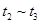 C.
C.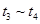 D.
D.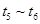
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知2A2(g)+B2(g)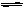 2C(g);△H=" -a" kJ/mol(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C的浓度为w mol/L,放出热量b kJ。请回答下列问题:
2C(g);△H=" -a" kJ/mol(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C的浓度为w mol/L,放出热量b kJ。请回答下列问题:
(1)比较a______b(填>、=、<)
(2)此反应的平衡常数表达式为______________________;若将反应温度升高到700℃,反应的平衡常数将_____________(增大、减小或不变)。
(3)若在原来的容器中,只加入2mol C,500℃时充分反应达平衡后,吸收热量ckJ,a、b、c之间满足何种关系__________________(用代数式表示)。
(4)能说明该反应已经达到平衡状态的是 (填序号,有一个或多个选项符合题意,下同)。
a、v(C)=2v(B2) b、容器内气体压强保持不变
c、v逆(A2)=2v正(B2) d、容器内的气体密度保持不变
(5)为使该反应的反应速率增大,且平衡向正反应方向移动的是_____________。
a、及时分离出C气体 b、适当升高温度
c、增大B2的浓度 d、选择高效的催化剂
(6)若将上述容器改为恒压容器(反应前体积相同),起始时加入2mol A2和1mol B2, 500℃时充分反应达平衡后,放出热量dkJ,则d_________b(填>、=、<)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com