

分析 (1)石墨中C-C原子之间存在共价键,碳碳单键中只含σ键、碳碳双键中一个是σ键、一个是π键,层层之间存在分子间作用力;
(2)根据图知,图2所示的晶体中与Ca2+离子最近且等距离的Ca2+离子数=3×8÷2;
Cu是面心立方晶胞,每个顶点和每个面心上分别含有一个Cu原子,图4中未标号的Cu原子形成晶体后周围最紧邻的Cu原子数12,Cu位于第四周期第IB族.
解答 解:(1)石墨中C-C原子之间存在共价键,碳碳单键中只含σ键、碳碳双键中一个是σ键、一个是π键,层层之间存在分子间作用力,所以石墨中存在的化学键是ABEF,故答案为:ABEF;
(2)根据图知,图2所示的晶体中与Ca2+离子最近且等距离的Ca2+离子数=3×8÷2=12;
Cu是面心立方晶胞,每个顶点和每个面心上分别含有一个Cu原子,图4中未标号的Cu原子形成晶体后周围最紧邻的Cu原子数为有标数字的Cu原子,Cu位于第四周期第IB族,
故答案为:12;12;第四周期第IB族.
点评 本题考查晶胞计算及化学键,为高频考点,明确物质构成微粒及微粒之间作用力、物质空间构型等是解本题关键,侧重考查学生分析判断及空间想象能力,难点是配位数的判断.


科目:高中化学 来源: 题型:选择题
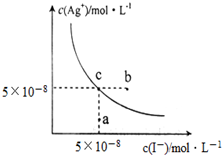 在t℃时,AgI在水中的沉淀溶解平衡曲线如图所示,又知t℃时AgBr的Ksp=5×10-13.下列说法不正确的是( )
在t℃时,AgI在水中的沉淀溶解平衡曲线如图所示,又知t℃时AgBr的Ksp=5×10-13.下列说法不正确的是( )| A. | 在t℃时,AgI的Ksp=2.5×10-15 mol2•L-2 | |
| B. | 图中b点有碘化银晶体析出 | |
| C. | 向c点溶液中加入适量蒸馏水,可使溶液由c点到a点 | |
| D. | 在t℃时,反应AgBr(s)+I-(aq)?AgI(s)+Br-(aq) 的平衡常数K=200 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
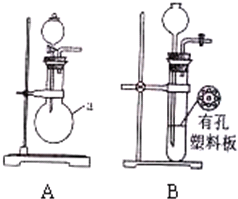 (1)用A装置制SO2,化学反应方程式为Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑.
(1)用A装置制SO2,化学反应方程式为Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NaN3与KN3结构类似,前者晶格能较小 | |
| B. | 第一电离能(I1):N>P>S | |
| C. | 钠晶胞结构属于体心结构,该晶胞分摊含2个钠原子 | |
| D. | 氮气常温下很稳定,是因为氮的电负性小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

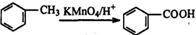


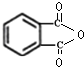 .
.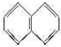 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 2molSO2、1molO2 | 4molSO3 |
| 平衡时n(SO3)/mol | 1 | m |
| 反应物的转化率 | α1 | α2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14 g乙烯和丙烯的混合物中总原子数为2NA个 | |
| B. | 在1mol的CH5+中所含的电子数为10NA | |
| C. | 16g CH4与18 g NH4+ 所含质子数相等 | |
| D. | 11.2 L的甲烷气体含有甲烷分子数一定为0.5NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 提倡人们购物时减少使用塑料袋,是为了减少白色污染 | |
| B. | 绿色化学的核心是利用化学原理从源头上减少和消除工业生产对环境的污染 | |
| C. | 为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术 | |
| D. | 硫氧化物和碳氧化物是形成酸雨的主要物质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com