

| A. | 石墨与O2生成CO2的反应是吸热反应 | |
| B. | 金刚石、石墨与O2反应,均可生成具有极性共价键的CO2 | |
| C. | 从能量角度看,金刚石比石墨更稳定 | |
| D. | C(金刚石,s)═C(石墨,s)△H=E3-E1 |
分析 A、根据图象看出石墨与O2的总能量比CO2的高;
B、根据图象看出金刚石、石墨的最终产物均为二氧化碳;
C、根据图象看出金刚石的能量大于石墨的能量;
D、根据图象看出C(金刚石,s)═C(石墨,s)△H=E1-E2.
解答 解:A、根据图象看出石墨与O2的总能量比CO2的高,所以石墨与O2生成CO2的反应是放热反应,故A错误;
B、根据图象看出金刚石、石墨均可生成具有极性共价键的CO2,故B正确;
C、根据图象看出金刚石的能量大于石墨的能量,能量越大越不稳定,故C错误;
D、根据图象看出C(金刚石,s)═C(石墨,s)△H=E1-E2,故D错误.
故选:B.
点评 本题侧重于化学反应原理的探究的考查,题目着重于考查学生的分析能力和自学能力,注意把握题给信息,难度不大.


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光导纤维中所用材料为晶体硅 | B. | 水玻璃可用作木材防火剂 | ||
| C. | 氯气可用于自来水的杀菌消毒 | D. | Fe2O3可以做油漆的颜料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入铝粉能放出H2的溶液中:Na+、Cl-、SO42-、Mg2+ | |
| B. | 0.1mol/L FeCl3溶液中:H+、K+、SCN-、I- | |
| C. | 加酚酞变红的溶液中:Na+、Ba2+、Cl-、Br- | |
| D. | 使紫色石蕊试液变红的溶液中:Ca2+、Na+、HCO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x=2.25 y=4.74% | B. | x=5 y=11.11% | ||
| C. | x=5 y=10% | D. | x=2.875 y=5.75% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
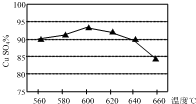 将某黄铜矿(主要成分为CuFeS2)和O2在一定温度范围内发生反应,反应所得固体混合物X中含有CuSO4、FeSO4、Fe2(SO4)3及少量SiO2等,除杂后可制得纯净的胆矾晶体(CuSO4•5H2O).
将某黄铜矿(主要成分为CuFeS2)和O2在一定温度范围内发生反应,反应所得固体混合物X中含有CuSO4、FeSO4、Fe2(SO4)3及少量SiO2等,除杂后可制得纯净的胆矾晶体(CuSO4•5H2O).| 粒子 | Cu2+ | Fe2+ | Fe3+ |
| 开始沉淀时的pH | 4.7 | 5.8 | 1.9 |
| 完全沉淀时的pH | 6.7 | 9.0 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.0mol•L-1 | B. | 3.5mol•L-1 | C. | 4.0mol•L-1 | D. | 8.0mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com