
(1)用盐酸进行滴定之前不需要过滤以除去BaCO3的理由是________________________;
(2)达到终点时,溶液的颜色变化是_____________;
(3)达到终点时消耗25.0 mL的HCl,则原混合液中NaOH的含量为_____________ g·mL-1;
(4)若向含有大量BaCO3固体的浊液中,分别加入下列试剂,则发生的变化是:
①加入少量BaCl2固体,则c(Ba2+)_____________,c (![]() )_____________。(填“增大”“减小”)。
)_____________。(填“增大”“减小”)。
②加入少量稀盐酸,则Ksp(BaCO3)_____________(填“增大”“减小”或“不变”)。
(1)酚酞变色时,pH大于7,此时BaCO3不可能溶解。
(2)红色变为无色 (3)5×10-3 (4)①增大 减小 ②不变
解析:(1)利用酚酞作指示剂时,达到滴定终点时,pH仍大于7,BaCO3不可能溶解,所以不用过滤除去BaCO3。
(3)NaOH + HCl![]() NaCl+H2O
NaCl+H2O
1 mol 1 mol
n (NaOH)
![]()
所以n(NaOH)=0.002 5 mol
NaOH的含量为
![]() =5×10
=5×10
(4)BaCO3固体的浊液中存在下列平衡:
BaCO3(s)![]() Ba2+(aq)+
Ba2+(aq)+![]() (aq)
(aq)
①加入少量BaCl2固体,Ba2+浓度增大,平衡逆向移动,c(![]() )就减小。
)就减小。
②Ksp(BaCO3)仅是温度的函数,与其他条件无关。


科目:高中化学 来源: 题型:
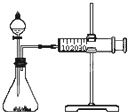 影响化学反应速率的因素很多,某同学设计了以下实验研究不同浓度的硫酸对反应速率的影响.药品:Cu、Fe、Na和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L);装置如图.
影响化学反应速率的因素很多,某同学设计了以下实验研究不同浓度的硫酸对反应速率的影响.药品:Cu、Fe、Na和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L);装置如图.查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 3 | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用蒸馏水洗净酸式滴定管后,注入标准溶液盐酸进行滴定 | B、用蒸馏水洗涤锥形瓶后再用NaOH溶液润洗,而后装入一定体积的NaOH溶液进行滴定 | C、用碱式滴定管量取10.00mLNaOH溶液放入用蒸馏水洗涤后的锥形瓶中,再加入适量蒸馏水和2滴甲基橙试液后进行滴定 | D、若改用移液管取待测液10.00mLNaOH溶液放入锥形瓶后,把留在移液管尖嘴处的液体吹入锥形瓶内,再加入1mL甲基橙指示剂后进行滴定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(08山东省威海市质检)(8分)测定一定体积的NaOH和Na2CO3混合溶液中NaOH的含量:取20mL溶液,加入足量BaCl2溶液后,滴入几滴酚酞,再用0.10mol?L-1盐酸进行滴定。
(1)用盐酸进行滴定之前不需要过滤以除去BaCO3的的理由是
(2)达到终点时,溶液的颜色变化是 ;
(3)达到终点时消耗25.0mL 的HCl,则原混合液中NaOH的含量为 g/mL;
(4)若向含有大量BaCO3固体的浊液中,分别加入下列试剂,则发生的变化是:
①加入少量BaCl2固体,则c(Ba2+) c(CO32+) (填“增大”、“减少”)。
②加入少量稀盐酸,则Ksp(BaCO3) (填“增大”、“减少”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com