
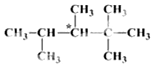
 人们将有机物中连有四个不同原子(或原子团)的碳原子称为手性碳原子,如图所示烷烃X中含有一个手性碳原子(用*标记).回答下列问题:
人们将有机物中连有四个不同原子(或原子团)的碳原子称为手性碳原子,如图所示烷烃X中含有一个手性碳原子(用*标记).回答下列问题:分析 (1)最长的碳链含有5个碳原子,从距离同一碳原子连接2个甲基最近的一端进行编号,进而进行命名;根据等效氢确定其一氯代物数目;
(2)含有手性碳原子的物质通常具有光学活性,同一碳原子连接四个不同基是:氢原子,甲基,乙基,丙基;
解答 解:(1)最长的碳链含有5个碳原子,从距离同一碳原子连接2个甲基最近的一端进行编号,该烷烃的名称为:2,2,3,4-四甲基戊烷,分子中含有5种化学环境不同的氢原子,其一氯代物有5种,
故答案为:2,2,3,4-四甲基戊烷;5;
(2)含有手性碳原子的物质通常具有光学活性,具有光学活性且式量最小的烷烃中同一碳原子连接四个不同基是:氢原子,甲基,乙基,丙基,分子式为C7H16;
故答案为:C7H16.
点评 本题考查有机物推断、有机物命名、同分异构体等,侧重考查学生对基础知识的迁移应用,需要学生熟练掌握有机化学基础,难度中等.


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:选择题
| A. | pH=7的溶液 | |
| B. | c(H+)=10-6mol/L纯水 | |
| C. | 使石蕊试液呈紫色的溶液 | |
| D. | 酸与碱恰好完全反应生成正盐的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾、漂白粉、臭氧的净水原理相同 | |
| B. | 用鸡蛋壳膜和蒸馏水除去淀粉胶体中的食盐不涉及化学变化 | |
| C. | 煤的干馏和石油的分馏都属于物理变化 | |
| D. | 亚硝酸钠是一种食品防腐剂,使用时其用量可以不加限制 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
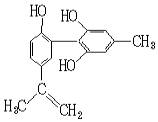 我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )
我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )| A. | 有机物分子式为C16H14O3 | |
| B. | 遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物 | |
| C. | 1 mol该物质分别与浓溴水、H2反应时最多消耗Br2和H2分别为4 mol、7 mol | |
| D. | 滴入KMnO4(H+)溶液,观察紫色褪去,可证明结构中存在碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 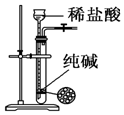 用图装置制取少量CO2气体 | |
| B. | 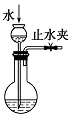 图可检查该装置的气密性 | |
| C. | 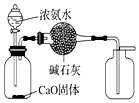 用图装置制取并收集干燥的NH3 | |
| D. | 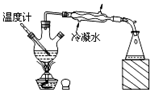 装置可分离沸点不同且互溶的液体混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LC2H2、C2H6的混合气体与22.4LC2H4中所含原子总数均为6NA | |
| B. | 常温下,1L PH=14的NaOH溶液中由水电离出的OH-个数为NA | |
| C. | 标准状况下,11.2L的12C16O和14N2的混合气体中所含中子数和原子数的差值为6NA | |
| D. | 将200mL0.1mol•L-1FeCl3溶液制成胶体,所得Fe(OH)3胶体粒子数为0.02NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| B. | Mg(OH)2与H2SO4反应:Mg2++2OH-+2H++SO42-═MgSO4↓+2H2O | |
| C. | 镁与醋酸反应 Mg+2H+═Mg2++H2↑ | |
| D. | Na2SO3溶液使酸性KMnO4溶液褪色:5SO32-+6H++2MnO4-═5SO42-+2Mn2++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
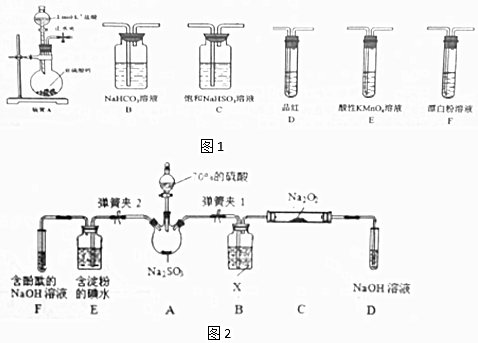
| 操作步骤 | 实验现象 | 解释原因 |
| 关闭弹簧夹2,打开弹簧夹1,注入硫酸至浸没三颈烧瓶中固体 | 若将带火星的木条放在D试管口处,木条不复燃 | SO2与Na2O2反应无O2生成,可能发生的化学反应方程式为①Na2O2+SO2=Na2SO4 |
| 若将带火星的木条放在D试管口处,木条复燃 | SO2与Na2O2反应有O2生成,发生的化学反应为:2SO2+2Na2O2═2Na2SO3+O2 | |
| 关闭弹簧夹1,打开弹簧夹2,残余气体进入E,F中. | E中②E 中溶液蓝色褪去 | E中反应的离子方程式③SO2+I2+2H2O=2I-+SO42-+4H+ |
| F中④F 中红色变浅或褪色 | F中反应为2OH-+SO2═SO32-+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com