
(20分)(1) 25℃时,在酸性、碱性、中性溶液中,C(H+)·C(OH-)= 。
某温度下纯水中的C(H+)= 2×10-7mol/L,则此时溶液中的C(OH-)= mol/L;若温度不变,滴入稀盐酸,使c(H+)= 5×10-4mol/L,则溶液中C(OH-)= mol/ L,pH= .
L,pH= .
(2) 室温下取0.2 mol·L-1HCl溶液与0.2 mol·L-1 MOH溶液等体积混合(忽略混合后溶液 体积的变化),测得混合溶液的pH=6,试回答以下问题:
体积的变化),测得混合溶液的pH=6,试回答以下问题:
① 混合溶液中水电离出的c(H+)________0.2mol·L-1 HCl溶液中水电离出的c(H+);(填“>”、“<”、或“=”)
② 求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Cl-)-c(M+)=__________ mol·L-1 c(H+)-c(MOH) =__________ mol·L-1
(3) 室温下如果取0.2 mol·L-1 MOH溶液与0.1 mol·L-1 HCl溶液等体积混合,测得混合溶液的pH<7,则说明MOH的电离程度________MCl的水解程度。(填“>”、“<”、或“=”),溶液中各离子浓度由大到小的顺序为_______________________。
(4)室温下,pH=13的强碱溶液与pH=2的强酸溶液混合,所得溶液的pH=7,则强碱与强酸的体积比是
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:化学(高一上)单元同步1+1测试卷 题型:038
已知硫酸银的溶解度较小, 25℃时为0.836g.
(1)25℃时,在烧杯中放入6.24g硫酸银固体,加 200g水,充分溶解后,所得溶液的体积为200mL.计算溶液中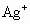 的物质的量浓度.
的物质的量浓度.
(2)若在上述烧杯中加入50mL 0.0268mol/L的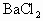 溶液,充分搅拌,溶液中的
溶液,充分搅拌,溶液中的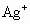 的物质的量浓度是多少?
的物质的量浓度是多少?
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:038
(1)25℃时,在烧杯中放入6.24 g硫酸银固体,加入200 g水,经充分溶解后,所得饱和溶液的体积为200 mL。计算溶液中Ag+的物质的量浓度是多少?
(2)若在上述烧杯中加入50 mL 0.0268 mol/L BaCl2溶液,充分搅拌,溶液中Ag+的物质的量浓度是多少?
(3)在(1)题烧杯中需加入多少L 0.0268 mol/L BaCl2溶液,才能使原溶液中Ag+浓度降低至0.0200 mol/L?
查看答案和解析>>
科目:高中化学 来源: 题型:038
硫酸银的溶解度较小,25℃时,每100g水仅溶解0.836g.
(1)25℃时,在烧杯中放人6.24g硫酸银固体,加200g水,经充分溶解后,所得饱和溶液的体积为200mL。计算溶液中Ag+的物质的量浓度.
(2)若在上述烧杯中加入50mL0.0268mol·L-1BaCl2溶液,充分搅拌,溶液中Ag的物质的量浓度是多少?
(3)在(1)题的烧杯中需加入多少升0.0268m01·L-1BaCl2溶液才能使原溶液中Ag+浓度降低至0.0200mol·L-1?
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸银的溶解度较小,25℃时,每100g水仅溶解0.836 g。
(1) 25℃时,在烧杯中放入 6.24g硫酸银固体,加200 g水,经充分溶解后,所得饱和溶液的体积为200 mL。计算溶液中Ag+的物质的量浓度。
(2) 若在上述烧杯中加入50 mL 0.0268 mol / L BaCl2溶液,充分搅拌,溶液中Ag+的物质的量浓度是多少?
(3) 在(1)题烧杯中需加入多少升0.0268 mol / L BaCl2溶液,才能使原溶液中Ag+浓度降低至0.0200 mol / L?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com