
| A. | 16g CH4与18g NH4+所含的质子数均为10NA | |
| B. | 将15.6g Na2O2投入到足量水中,反应后溶液中的氧原子数为0.4NA | |
| C. | 在1L 0.1 mol•L-1的碳酸钠溶液中,阴离子总数一定大于0.lNA | |
| D. | 2molNO和1 mol O2混合,所得气体的分子数为2NA |
分析 A.甲烷中含有10个质子,铵根离子中含有11个电子;
B.水中含有氧原子;
C.碳酸根离子水解生成氢氧根离子和碳酸氢根离子;
D.根据质量守恒定律进行判断,反应前后原子的总物质的量不变.
解答 解:A.16gCH4的物质的量为1mol,含有10mol质子;18gNH4+的物质的量为1mol,含有11mol质子,二者含有的质子数不同,故A错误;
B.水中含有氧原子,氧原子数大于0.4NA,故B错误;
C.常温下,100mL 1mol•L-1 Na2CO3溶液中,碳酸根离子水解生成氢氧根离子和碳酸氢根离子,阴离子总数大于0.1NA,故C正确;
D.将2mol NO和1mol O2混合后,反应过程中原子的物质的量不变,总原子的物质的量为:2×2mol+2mol=6mol,体系中的原子总数为6NA,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的应用,主要考查质量换算物质的量计算微粒数,盐类水解的分析,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1mol H2完全燃烧生成气态水放出285.8kJ热量,则H2的燃烧热为-285.8kJ•mol-1 | |
| B. | 测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度,NaOH起始温度和反应后最高温度 | |
| C. | 在101 kPa时,1mol C与适量O2反应生成1mol CO时,放出110.5kJ热量,则C的燃烧热为110.5kJ•mol-1 | |
| D. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.31 kJ•mol-1.若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量等于57.3kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有aA、bB、cC、dD、eE五种短周期元素,它们都是生命不可缺少的重要元素.已知它们的原子序数有如下关系:a+b=c,a+c=d,c+d=e;B、D、E都有多种同素异形体,B的化合物种类与A的化合物种类何者最多尚有争议.据此,回答下列有关问题:
现有aA、bB、cC、dD、eE五种短周期元素,它们都是生命不可缺少的重要元素.已知它们的原子序数有如下关系:a+b=c,a+c=d,c+d=e;B、D、E都有多种同素异形体,B的化合物种类与A的化合物种类何者最多尚有争议.据此,回答下列有关问题: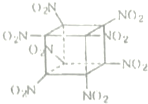 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓HCl、浓H2SO4、浓HNO3均具有氧化性,都属氧化性酸 | |
| B. | 根据分散系是否有丁达尔效应将分散系分为溶液、胶体和浊液 | |
| C. | NaOH、HNO3、NaNO3在水溶液中均能电离出离子,都属离子化合物 | |
| D. | Na2O2、HCl、BaSO4在熔融状态或溶于水时均能导电,都属电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 两同学为制得纯净的Fe(OH)2,根据如图所示的装置,回答问题.A管中是Fe+H2SO4,B管中是NaOH溶液
两同学为制得纯净的Fe(OH)2,根据如图所示的装置,回答问题.A管中是Fe+H2SO4,B管中是NaOH溶液查看答案和解析>>
科目:高中化学 来源: 题型:解答题
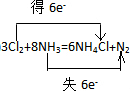 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg、Ag | B. | Fe、Mg | C. | Al、Zn | D. | Mg、Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “煤改气”、“煤改电”等改造工程有利于减少雾霾天气 | |
| B. | PM2.5含有的铅、镉、铬、钒、砷等元素均为对人体有害的金属元素 | |
| C. | 田间焚烧秸秆易造成灰霾,灰霾粒子平均直径在1000~2000nm之间,能发生丁达尔效应 | |
| D. | 汽车尾气净化装置可将尾气中的NO和CO等有害气体转化为N2和CO2,该装置中的催化剂可降低NO和CO反应的活化能,有利于提高该反应的平衡转化率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com