
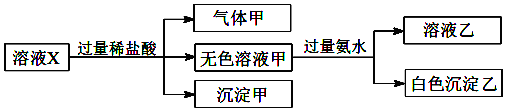
| A. | 气体甲一定是纯净物 | |
| B. | 沉淀甲是硅酸和硅酸钙的混合物 | |
| C. | CO32-和SO42-一定不存在于溶液X中 | |
| D. | Na+、[Al(OH)4]-和SiO32-一定存在于溶液X中 |
分析 X中只可能溶有Na+、Ca2+、Fe3+、[Al(OH)4]-、SiO32-、CO32-、SO42-中的若干种离子,由实验可知沉淀甲为H2SiO3,气体甲含CO2,因盐酸易挥发,甲中可能混有HCl,则原溶液中一定含SiO32-、CO32-,则不含Ca2+、Fe3+,由溶液甲与氨水反应生成白色沉淀乙为Al(OH)3,溶液乙含氯化铵,则原溶液一定含[Al(OH)4]-,由电荷守恒可知,溶液含阳离子为Na+,不能确定是否含SO42-,以此来解答.
解答 解:A.由上述分析可知,甲可能为CO2、HCl的混合物,故A错误;
B.沉淀甲是硅酸沉淀,由离子共存可知原溶液中不含Ca2+,故B错误;
C.不能确定是否含SO42-,故C错误;
D.由上述分析可知,Na+、[Al(OH)4]-和SiO32-一定存在于溶液X中,故D正确;
故选D.
点评 本题考查常见离子的检验,为高频考点,把握流程中发生的反应、离子检验方法、离子共存为解答的关键,侧重分析与应用能力的考查,注意气体及沉淀的判断,题目难度不大.


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:解答题

| 实验步骤 | 实验现象 | ||
| B瓶 | C瓶 | D瓶 | |
| 实验1:取样,滴加紫色石蕊溶液 | 变红,缓慢褪色 | 变红,缓慢褪色 | 立即褪色 |
| 实验2:取样,测定溶液的pH | 3 | 12 | 7 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2是还原剂 | B. | C被氧化 | ||
| C. | SiO2发生氧化反应 | D. | C得到电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲的体积比乙的体积大 | B. | 甲的分子数比乙的分子致少 | ||
| C. | 甲的压强比乙的压强大 | D. | 甲的摩尔体积比乙的华尔体积大 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 实验操作 | 实验现象 | 实验结论 |
| 1 | 2 | 裴置B中的溶液还含有氢氧化钠 |
| 3 | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{6a}{b}$ mol•L-1 | B. | $\frac{3a}{b}$ mol•L-1 | C. | $\frac{3b}{a}$ mol•L-1 | D. | $\frac{b}{a}$ mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com