
| A. | 酸性:H2SO4<HClO | B. | 气态氢化物稳定性:HCl>H2S | ||
| C. | 离子半径:Na+>F- | D. | 碱性:NaOH>KOH |
分析 A.硫酸是强酸、HCl是弱酸;
B.元素的非金属性越强,其氢化物的稳定性越强;
C.电子层结构相同的离子,离子半径随着原子序数增大而减小;
D.元素的金属性越强,其最高价氧化物的水化物碱性越强.
解答 解:A.硫酸是强酸、HCl是弱酸,所以酸性:H2SO4>HClO,故A错误;
B.元素的非金属性越强,其氢化物的稳定性越强,非金属性Cl>S,所以气态氢化物稳定性:HCl>H2S,故B正确;
C.电子层结构相同的离子,离子半径随着原子序数增大而减小,这两种离子电子层结构相同,且原子序数Na>F,所以离子半径:Na+<F-,故C错误;
D.元素的金属性越强,其最高价氧化物的水化物碱性越强,金属性K>Na,所以碱性NaOH<KOH,故D错误;
故选B.
点评 本题考查元素周期律,为高频考点,明确同一主族、同一周期元素结构及性质递变规律是解本题关键,知道离子半径大小影响因素及比较方法,题目难度不大.


科目:高中化学 来源: 题型:推断题
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | O | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的焓变为负值 | |
| B. | 化学方程式为 NO2(g)+CO(g)?CO2(g)+NO(g) | |
| C. | 降温,正反应速率减小 | |
| D. | 恒温时,增大压强颜色加深,平衡逆向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
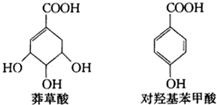 以莽草酸为原料,经多步反应可制取对羟基苯甲酸.莽草酸、对羟基苯甲酸的结构简式如图.下列说法正确的是( )
以莽草酸为原料,经多步反应可制取对羟基苯甲酸.莽草酸、对羟基苯甲酸的结构简式如图.下列说法正确的是( )| A. | 莽草酸、对羟基苯甲酸都属于芳香族化合物 | |
| B. | 1mol莽草酸与NaOH溶液反应,最多消耗4 mol NaOH | |
| C. | 利用FeCl3溶液可鉴别莽草酸和对羟基苯甲酸 | |
| D. | 对羟基苯甲酸较稳定,在空气中不易被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯的二氯代物和苯的一硝基代物 | B. | C3H6Br2和C5H11Br | ||
| C. | 乙烷的二氯代物和丙烷的一氯代物 | D. | 丙烷的一氯代物和戊烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com