
| A. | 把CaO放入水中:CaO═Ca2++O2- | |
| B. | 加热NaHSO4至熔化:NaHSO4═Na++H++SO42- | |
| C. | 把Al2(SO4)3放入水中:Al2(SO4)3═Al3++SO42- | |
| D. | 把NaCl放入水中:NaCl═Na++Cl- |
分析 A.氧化钙熔融状态电离出钙离子与阳离子;
B.熔融状态下硫酸根离子不能拆;
C.原子个数、电荷数不守恒;
D.氯化钠为强电解质,水溶液中完全电离;
解答 解:A.氧化钙熔融状态电离出钙离子,电离方程式::CaO═Ca2++O2,水中不能电离,故A错误;
B.加热NaHSO4至熔化,电离方程式:NaHSO4═Na++HSO4-,故B 错误;
C.把Al2(SO4)3放入水中:Al2(SO4)3═2Al3++3SO42-,故C错误;
D.把NaCl放入水中,离子方程式:NaCl═Na++Cl-,故D正确;
故选:D.
点评 本题考查了电解质电离方程式的书写,明确电解质强弱及电离方式是解题关键,注意硫酸氢钠在熔融状态下只断裂离子键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++H++OH-+SO42-═BaSO4↓+H2O | |
| B. | NH4HCO3溶液与少量KOH浓溶液共热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 向浓硝酸中加入铜片,Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| D. | 二氧化硫通入次氯酸钙溶液:SO2+Ca2++2ClO-+H2O═CaSO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 短周期第ⅣA与ⅦA族元素的原子间构成的分子,均满足原子最外层8电子结构 | |
| B. | 能量高的电子在离核近的区域运动,能量低的电子在离核远的区域运动 | |
| C. | 乙酸与丙二酸互为同系物 | |
| D. | 同一原子中,1s、2s、3s所能容纳的电子数越来越多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PH=3的盐酸和PH=11的氨水 | B. | PH=3的硝酸和PH=11的Ba(OH)2溶液 | ||
| C. | PH=3的硫酸和PH=11的氨水 | D. | PH=3的醋酸和PH=11的Ba(OH)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期元素中X的金属性最强 | |
| B. | 原子半径X>Y,离子半径X+>Y- | |
| C. | 同族元素中Z的氢化物稳定性最高 | |
| D. | 同周期元素中Y的最高价含氧酸的酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
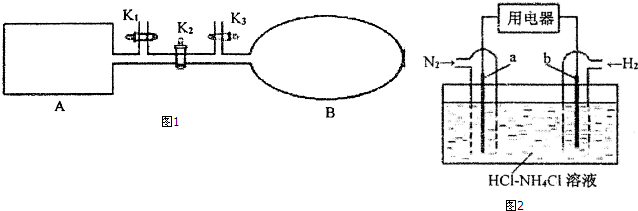
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应 | 大气固氮 N2(g)+O2(g)?2NO(g) | 工业固氮 N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
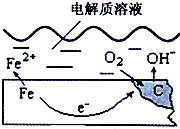 如图是钢铁在潮湿空气里发生电化学腐蚀原理示意图,发生的反应为:
如图是钢铁在潮湿空气里发生电化学腐蚀原理示意图,发生的反应为:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com