
【题目】下列物质属于纯净物的是( )
A.氯水B.洁净的空气C.液氯D.氢氧化钠溶液
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】中国女药学家屠呦呦因创制新型抗疟药——青蒿素(结构如图)和双氢青蒿素的贡献,挽救了全球特别是发展中国家的数百万人的生命”。青蒿素是从植物黄花蒿茎叶中提取的,荣获2015年诺贝尔奖生物学或医学奖。下列有关青蒿素的叙述不正确的是

A. 分子式为C15H22O5
B. 它在乙醚中的溶解度大于在水中的溶解度
C. 能发生取代反应、水解反应、加成反应,不能发生氧化反应
D. 该物质不稳定,容易受到热和还原性物质的影响而发生变质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人类生产和生活中必不可少的重要金属(如图)。

(1)自然界一共存在四种稳定的铁原子,分别是54Fe、56Fe、57Fe和58Fe,其中58Fe原子中子数与质子数之差为___。计算铁元素的近似相对质量的计算式为:54×a1%+56×a2%+57×a3%+58×a4%,其中a1%、a2%…是指各同位素的____。
(2)铁原子中有___种能量不同的电子,铁原子次外层的电子云有____种不同的伸展方向。
(3)与铁同周期的主族元素中,最高价氧化物对应水化物中,碱性最强的化合物与酸性最强的化合物的化学反应方程式为_________________。
(4)要用铁片、锌片、直流电源和导线完成铁片镀锌的实验,铁片应置于阴极,电解质溶液是____。
(5)高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原为Fe3+,配平制取高铁酸钠的化学方程式:___Fe(NO3)3+___NaOH+____Cl2→___Na2FeO4+ ___NaNO3+___NaCl+___H2O;高铁酸钠除了能消毒杀菌外,还能吸附水中的悬浮物,其原因是_______________。
(6)0.03mol的铁加到过量的 HNO3中,加热,铁完全溶解,若生成 NO、NO2的混和气体共1.12L(标准状况),将盛有此气体的容器倒扣在水中,通入标准状况下一定体积的O2,恰好使气体全部溶于水生成HNO3,则通入O2的体积_____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种有机物有如下转化关系。已知B可以发生银镜反应,D气体密度是氢气的14倍。
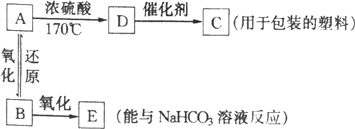
根据图示,
(1)试写出A、C、E的结构简式:A_____、C_______、E________。
(2)写出下列反应的化学方程式:
A→D:_______________________;
A→B: _______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种短周期主族元素,原子序数依次增大。其中B的单质在常温下为双原子分子,它与A的单质可形成气态分子X,X的水溶液呈碱性;D的简单阳离子与X具有相同电子数,且D是同周期元素中原子半径最大的元素;E元素的原子最外层比次外层少两个电子,C、F两种元素的原子最外层共有13 个电子。则
(1)B的原子结构示意图为 ;X的化学名称为 。
(2)B单质的电子式为 ;E的气态氢化物的结构式为 ;C与D形成的两种化合物中,原子个数比为1:1的那种物质所含有的化学键为 ,该物质属于 (填“离子化合物”或“共价化合物”)。
(3)B、C、E分别与A形成的化合物中最稳定的是 (写化学式)。
(4)D是同周期简单阳离子中离子半径最 的元素。
(5)F的单质在反应中常作 剂(填“氧化”或“还原”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小明上次考试化学没考好,很沮丧。班主任杜老师开导他说:学习化学一是要有兴趣;二是要做好归纳总结、发现规律,同时还要对特殊情况适当记忆;三是要重视基础,抓住问题的本质。听了老师的话,小明总结了刚学习过的内容,你认为正确的是( )
①由非金属元素组成的化合物一定是共价化合物
②离子化合物一定含离子键,也可能含共价键
③共价键既可能存在于单质和共价化合物中,也可能存在于离子化合物中
④金属性越强的元素相应的简单阳离子氧化性一般越弱
⑤含金属元素的化合物不一定是离子化合物
⑥任何元素的原子都是由核外电子和核内中子、质子组成的
⑦化学反应一定伴随着能量的变化
⑧质子数相同的微粒一定属于同种元素
A. ②③④⑤⑦ B. ②③⑤⑦⑧ C. ①③④⑥⑦ D. ①②④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D都是短周期元素,原子半径:D>C>A>B。已知:A、B同周期,A、C处于同一主族;C原子核内的质子数等于A、B原子核内的质子数之和;C原子最外层电子数是 D原子最外层电子数的3倍。试回答:
(1)写出元素的名称:A________、C________。
(2)写出由B、D组成的两种化合物的电子式分别为:_______、_______。
(3)C的固态氧化物属于_______晶体,写出表示C的氧化物的一种重要的工业用途_______。
(4)A、C的最高价氧化物对应水化物中酸性较强的是_______ (写水化物的分子式)。
(5)写出C的氧化物与D的最高价氧化物对应水化物反应的离子方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH)重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备CH3OH的反应为:CO(g)+2H2(g)![]() CH3OH(g) △H
CH3OH(g) △H
(1)T℃时,在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图一所示。

①反应2min到5min,用氢气表示的平均反应速率v(H2)=_____________。
②下列说法正确的是_____________(填字母序号)。
A.达到平衡时,CO的转化率为50%
B.5min后容器中压强不再改变
C.达到平衡后,再充入氩气,反应速率增大
D.2min前v(正)>v(逆),2min后v(正)<v(逆)
E.加入催化剂可以加快化学反应速率,同时提高CO和H2平衡的转化率
③下列叙述可以说明该反应在该条件下已经达到化学平衡的是__________(填字母序号)。
A.混合气体密度不发生改变 B.混合气体的平均相对分子质量不再发生改变
C.v(CO)正=2v(H2)逆 D.n(CO)与n(H2)的比值不变
(2)某温度下,在一容积可变的恒压密闭容器中分别充入1molCO和1.2molH2,达到平衡时容器体积为2L,且含有0.5molCH3OH(g),则该反应平衡常数的值为_______,此时向容器中再通入0.3molCO和0.3mo1CH3OH(g),则此平衡将______________(填“向正反应方向”、“不”或“向逆反应方向”)移动。
(3)若压强、投料比x=n(CO)/n(H2)对反应的影响如图二所示,则图中曲线所示的压强关系:p1_____p2(填“=”“>”或“<”)。
(4)工业上另一种合成甲醇的方法是利用CO2和H2,已知:CH3OH、H2的燃烧热(△H)分別为-726.9kJ/mol、-285.8kJ/mol,则常温下CO2和H2反应生成CH3OH和H2O的热化学方程式是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素A、B、C、D、E原子序数依次增大,结合下列信息:A原子核外电子总数是内层电子数的三倍,A、E同主族;B的最高价氧化物对应的水化物F与其气态氢化物G反应,得到离子化合物H;C的焰色应呈黄色;D在同周期中形成的简单离子,其离子半径最小;
回答下列问题:
(1)写出D在元素周期表中的位置:______________。
(2)化合物H的水溶液pH_______7(填“大于”、“等于”“小于”),其原因是______________用离子方程式表示。
(3)上述元素的最高价氧化物对应水化物中,有一种物质在一定条件下均能与其他四种物质发生化学反应,写出该物质的电子式:_______。
(4)请设计实验证明A、B、E的非金属性强弱关系:________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com