
| A. | 铝是一种既可以与强酸反应又可以与强碱反应的金属 | |
| B. | 氧化铝按组成划分属于金属氧化物,按性质划分属于碱性氧化物 | |
| C. | 氢氧化铝具有较高的熔点和沸点,常用于制造耐火材料 | |
| D. | 铝是地壳中含量最多的元素,铝土矿是铝元素在地壳中的主要存在形式之一 |
分析 A、铝与强酸反应生成铝盐和氢气,与强碱反应生成偏铝酸盐和氢气;
B、氧化铝与酸和碱反应都生成盐和水;
C、氧化铝具有较高的熔点和沸点,常用于制造耐火材料;
D、铝是地壳中含量最多的金属元素.
解答 解:A、铝与强酸反应生成铝盐和氢气,与强碱反应生成偏铝酸盐和氢气,所以铝是一种既可以与强酸反应又可以与强碱反应的金属,故A正确;
B、氧化铝与酸和碱反应都生成盐和水,所以氧化铝是两性氧化物,故B错误;
C、氧化铝具有较高的熔点和沸点,常用于制造耐火材料,而氢氧化铝不稳定受热易分解,故C错误;
D、铝是地壳中含量最多的金属元素,含量最多是元素是氧元素,故D错误;
故选A.
点评 本题考查了铝及其铝的化合物的性质,明确其性质是解本题关键,注意氧化铝和氧化镁是耐火材料,注意基础知识的积累和运用,题目难度不大.


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:选择题
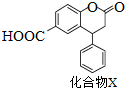
| A. | 分子中两个苯环一定处于同一平面 | |
| B. | 不能与饱和Na2CO3溶液反应 | |
| C. | 在酸性条件下水解,水解产物只有一种 | |
| D. | 1 mol化合物X最多能与2 molNaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子的价电子排布为ns2np1~6的元素一定是主族元素 | |
| B. | 基态原子的p能级上有5个电子的元素一定是ⅦA族元素 | |
| C. | 原子的价电子排布为(n-1)d6~8ns2的元素一定位于ⅢB~ⅦB族 | |
| D. | 基态原子的N层上只有1个电子的元素一定是主族元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
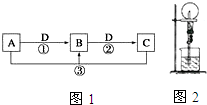 已知A、B、C、D 是中学化学的常见物质.且A、B、C 均含有同一种元索.在一定条件下它们之间的相气转化关系如图1所示(部分反应中的H2O已略去).
已知A、B、C、D 是中学化学的常见物质.且A、B、C 均含有同一种元索.在一定条件下它们之间的相气转化关系如图1所示(部分反应中的H2O已略去).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
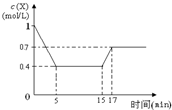 一定条件下,向密闭容器中加入1mol/L X发生反应:3X(g)?Y(g)+Z(g)△H<0,反应到5min时达到平衡,在15min时改变某一条件,到17min时又建立新平衡,X的物质的量浓度变化如图,下列说法中不正确的是( )
一定条件下,向密闭容器中加入1mol/L X发生反应:3X(g)?Y(g)+Z(g)△H<0,反应到5min时达到平衡,在15min时改变某一条件,到17min时又建立新平衡,X的物质的量浓度变化如图,下列说法中不正确的是( )| A. | 0~5 min时,该反应的速率为v(X)=0.12 mol/(L•min) | |
| B. | 15 min时改变的条件可能是减小压强 | |
| C. | 15 min时改变的条件可能是升高温度 | |
| D. | 从初始到17 min时,X的转化率为30% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3NA | |
| B. | 室温下,1LpH=12的NaOH溶液中,由水电离的OH-离子数目为0.01NA | |
| C. | 氢氧燃料电池负极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA | |
| D. | 0.1mol丙烯酸中含有双键的数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有②⑦ | B. | 只有①⑦ | C. | 只有⑦ | D. | 只有①⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com