
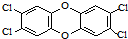
 二噁英是一类芳香族化合物的多氯代衍生物的总称,结构稳定,难以被自然分解,是公认的最危险的致癌物质之一.如图是其中一种的结构.下列说法中不正确的是
二噁英是一类芳香族化合物的多氯代衍生物的总称,结构稳定,难以被自然分解,是公认的最危险的致癌物质之一.如图是其中一种的结构.下列说法中不正确的是| A. | 它能发生还原反应 | B. | 它能燃烧 | ||
| C. | 它的一溴取代物只有一种 | D. | 此分子中共平面的原子最多有18个 |
科目:高中化学 来源: 题型:选择题
| A. | MgF2晶体中的化学键是共价键 | |
| B. | 某物质在熔融态能导电,则该物质中一定含有离子键 | |
| C. | N2和Cl2两种分子中,每个原子的最外层都具有8电子稳定结构 | |
| D. | 干冰是分子晶体,其溶于水生成碳酸的过程只需克服分子间作用力 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加碘盐的溶液遇淀粉变蓝 | |
| B. | 汽油和乙烯均为石油分馏得到的产品 | |
| C. | CaO可用作工业废气的脱硫剂 | |
| D. | 蔗糖、淀粉、油脂水解均能生成电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
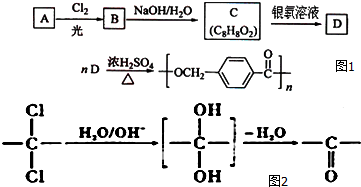
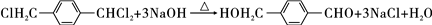 ,该反应过程中生成的不稳定中间体的结构简式应是
,该反应过程中生成的不稳定中间体的结构简式应是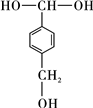 .
.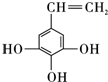 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的 |
| A | 将二氧化硫气体通入紫色石蕊试液中,观察溶液颜色变化 | 证明二氧化硫具有漂白性 |
| B | 向2mL 1mol•L-1NaOH溶液中先加入3滴1mol•L-1 FeCl3,再加入3滴1mol•L-1MgCl2溶液 | 证明K[Mg(OH)2]>K[Fe(OH)3] |
| C | 相同条件下,向两支盛有相同体积不同浓度H2O2溶液的试管中分别滴入适量相同浓度的CuSO4溶液和FeCl3溶液 | 探究Cu2+、Fe3+对H2O2分解速率的影响 |
| D | 向2mL品红溶液和2mL加入少许醋酸的品红溶液中分别滴入3滴NaClO的84消毒液,观察红色褪色的快慢 | 证明溶液pH的减少,84消毒液的氧化能力增强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 室温下,0.2mol•L-1的一元碱BOH与等浓度的盐酸等体积混合后,所得溶液中部分微粒的组分及浓度如图所示,下列对混合溶液的分析正确的是( )
室温下,0.2mol•L-1的一元碱BOH与等浓度的盐酸等体积混合后,所得溶液中部分微粒的组分及浓度如图所示,下列对混合溶液的分析正确的是( )| A. | 溶液可能显中性或酸性 | B. | 升温,c(X)增大,c(Y)减小 | ||
| C. | c(B+)+c(Y)=c(Cl-) | D. | 稀释溶液,c(X)增大,c(Z)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| pH | Ca2+、Mg2+总浓度 | 细菌总数 |
| 6.5~8.5 | <0.004 5mol•L-1? | <100个•mL-1? |
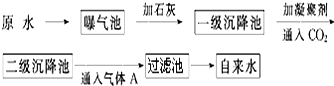
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
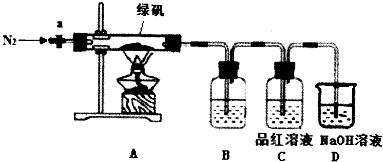
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
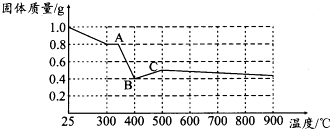 草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸亚铁晶体的化学性质,进行了一系列实验探究.
草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸亚铁晶体的化学性质,进行了一系列实验探究.| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
| 取少量黑色固体,加入适量稀盐酸或稀硫酸, 在溶液中加入硫氰化钾溶液 | 溶液不变红色,则假设一成立, 溶液变成红色,则假设一不成立 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com