
| A.1体积NO | B.2体积NO2和0.5体积O2 |
| C.2体积O2 | D.0.25体积O2 |
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源:不详 题型:填空题
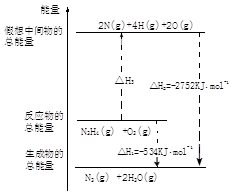
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.常温下都用铜容器贮存 | B.露置在空气中,容器内酸液的质量都减轻 |
| C.常温下都能与铜较快反应 | D.露置在空气中,容器内酸液的浓度都降低 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
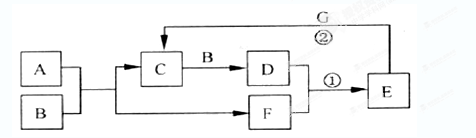
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Cu+HNO3→ | B.N2+O2→ |
| C.NH3+O2→ | D.NO2+H2O→ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
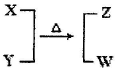
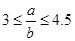 ,则被还原的HNO3的质量为 g。
,则被还原的HNO3的质量为 g。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
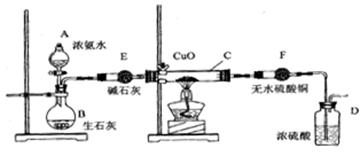
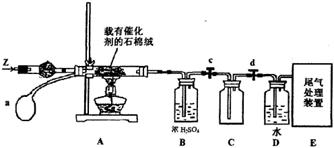
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.9.02g | B.8.26g | C.8.61g | D.7.04g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com