
【题目】钛酸钡粉体是电子陶瓷元器件的重要基础原料。工业上以TiCl4、BaCO3、H2C2O4等物质为原料制备草酸氧钛钡晶体[BaTiO(C2O4)2·4H2O],再高温煅烧制得钛酸钡粉体。请回答下列问题:
(1)基态Ti原子的价电子排布图为__,同周期元素中,基态原子未成对电子数与Ti相同的元素有___(填元素符号)。
(2)第IIA族(碱土金属)元素的原子序数、原子半径、第一电离势(从元素的气态基态原子中将一个电子移至无穷远处时所需做的功)如下表所示。
元素 | 原子序数 | 原子半径/pm | 每一电离势/eV |
Be | 4 | 89 | 9.32 |
Mg | 12 | 136 | 7.644 |
Ca | 20 | 174 | 6.111 |
Sr | 38 | 191 | 5.692 |
Ba | 56 | 198 | 5.21 |
①由上表数据可知,相邻元素原子半径差值r(Be-Mg)、r(Mg-Ca)明显大于r(Ca-Sr)、r(Sr-Ba),试解释其原因__。
②由上表数据可知,随原子序数的递增,第IIA族元素的第一电离势依次减小,试解释其原因__。
(3)已知草酸分子的结构简式为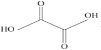 。
。
①草酸分子中,碳原子的杂化方式为__。
②由此结构简式可预测草酸__(填“难溶”“微溶”或“易溶”)于水和乙醇。
③已知草酸和液溴的相关数据如下,草酸熔点高于液溴的原因是__。
名称 | 化学式 | 相对子质量 | 熔点 |
草酸 | H2C2O4 | 90 | 101℃ |
液溴 | Br2 | 160 | -7.2℃ |
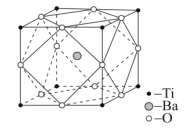
(4)设NA是阿伏加德罗常数的值,已知钛酸钡的立方晶胞结构如图所示,晶胞中Ti原子的配位数为__,其晶胞参数约为apm,钛酸钡晶体的密度ρ=__g.cm-3。(列式即可)
【答案】![]() Ni、Ge、Se Be与Mg、Mg与Ca核电荷数相差8,原子核对核外电子的引力增加较小,而增加一个电子层时原子半径增大幅度较大;Ca与Sr、Sr与Ba核电荷数相差18,原子核对核外电子的引力增加较大,而增加一个电子层时原子半径增大幅度较小 随着原子序数的递增,原子半径依次增大,原子核对最外层电子的引力减弱,第一电离势依次减小 sp2 易溶 草酸能形成分子间氢键,熔点较高;液溴分子间只存在范德华力,熔点较低 6
Ni、Ge、Se Be与Mg、Mg与Ca核电荷数相差8,原子核对核外电子的引力增加较小,而增加一个电子层时原子半径增大幅度较大;Ca与Sr、Sr与Ba核电荷数相差18,原子核对核外电子的引力增加较大,而增加一个电子层时原子半径增大幅度较小 随着原子序数的递增,原子半径依次增大,原子核对最外层电子的引力减弱,第一电离势依次减小 sp2 易溶 草酸能形成分子间氢键,熔点较高;液溴分子间只存在范德华力,熔点较低 6 ![]()
【解析】
(1)基态Ti原子的电子排布式为1s22s22p63s23p63d24s2,由此可画出价电子排布图,同周期元素中,基态原子未成对电子数与Ti相同的元素,其价电子排布可能为3d84s2、4s24p2、4s24p4。
(2)①由上表数据可知,相邻元素原子半径差值r(Be-Mg)、r(Mg-Ca)明显大于r(Ca-Sr)、r(Sr-Ba),可从核电荷数的变化、原子半径的变化进行解析。
②由上表数据可知,随原子序数的递增,第IIA族元素的第一电离势依次减小,从原子半径变化及原子核对外层电子的吸引力解释原因。
(3)①草酸分子中,碳原子的价层电子对数为3,由此可得出杂化方式。
②草酸分子中含有水溶性基团羧基,由此可预测草酸在水和乙醇中的溶解性。
③草酸和液溴都形成分子晶体,草酸分子间能形成氢键,熔点高于液溴。
(4)从晶胞中Ti原子周围O原子的分布,可确定其配位数;由晶胞参数可求出体积,再利用晶胞中所含原子数计算质量,最后求出钛酸钡晶体的密度。
(1)基态Ti原子的电子排布式为1s22s22p63s23p63d24s2,由此可画出价电子排布图为![]() ,同周期元素中,基态原子未成对电子数与Ti相同的元素,其价电子排布可能为3d84s2、4s24p2、4s24p4,则对应元素为Ni、Ge、Se。答案为:
,同周期元素中,基态原子未成对电子数与Ti相同的元素,其价电子排布可能为3d84s2、4s24p2、4s24p4,则对应元素为Ni、Ge、Se。答案为:![]() ;Ni、Ge、Se;
;Ni、Ge、Se;
(2)①由上表数据可知,相邻元素原子半径差值r(Be-Mg)、r(Mg-Ca)明显大于r(Ca-Sr)、r(Sr-Ba),可从核电荷数的变化、原子半径的变化进行解析,其原因为Be与Mg、Mg与Ca核电荷数相差8,原子核对核外电子的引力增加较小,而增加一个电子层时原子半径增大幅度较大;Ca与Sr、Sr与Ba核电荷数相差18,原子核对核外电子的引力增加较大,而增加一个电子层时原子半径增大幅度较小。答案为:Be与Mg、Mg与Ca核电荷数相差8,原子核对核外电子的引力增加较小,而增加一个电子层时原子半径增大幅度较大;Ca与Sr、Sr与Ba核电荷数相差18,原子核对核外电子的引力增加较大,而增加一个电子层时原子半径增大幅度较小;
②由上表数据可知,随原子序数的递增,第IIA族元素的第一电离势依次减小,从原子半径变化及原子核对外层电子的吸引力解释,其原因为随着原子序数的递增,原子半径依次增大,原子核对最外层电子的引力减弱,第一电离势依次减小。答案为:随着原子序数的递增,原子半径依次增大,原子核对最外层电子的引力减弱,第一电离势依次减小;
(3)①草酸分子中,碳原子的价层电子对数为3,则碳原子的杂化方式为sp2。答案为:sp2;
②草酸分子中含有水溶性基团羧基,由此可预测草酸易溶于水和乙醇。答案为:易溶;
③草酸和液溴都形成分子晶体,草酸分子间能形成氢键,由此确定草酸熔点高于液溴的原因是草酸能形成分子间氢键,熔点较高;液溴分子间只存在范德华力,熔点较低。答案为:草酸能形成分子间氢键,熔点较高;液溴分子间只存在范德华力,熔点较低;
(4)晶胞中,Ti原子周围距离最近的O原子位于棱的中点,由此可确定其配位数为![]() =6;在晶胞内,含有1个Ba离子,含Ti原子数为8×
=6;在晶胞内,含有1个Ba离子,含Ti原子数为8×![]() =1,O原子数为12×
=1,O原子数为12×![]() =3,则钛酸钡晶体的密度ρ=
=3,则钛酸钡晶体的密度ρ=![]() =
=![]() g.cm-3。答案为:6;
g.cm-3。答案为:6;![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列表述与示意图一致的是
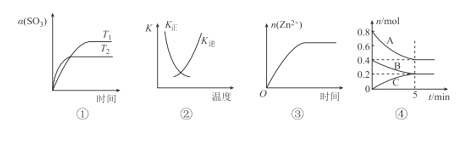
A.图①表示2SO3(g)=2SO2(g)+O2(g) △H>0,SO3的平衡转化率随温度、时间的变化
B.图②中曲线表示反应H2(g)+I2(g)=2HI(g) △H<0正、逆反应的平衡常数K随温度的变化
C.图③表示20 mL 0.1 mol/L稀盐酸与过量锌粒混合时,n(Zn2+)随时间的变化
D.图④反应从开始到平衡的平均反应速率v(B)=0.04molL-1min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置能达到实验目的的是( )
|
|
|
|
A.测定一定时间内生成 H2的反应速率 | B.可以进行中和热的测定实验 | C.比较温度对化学反应速率的影响 | D.比较Cu2+、Fe3+对 H2O2分解速率的影响 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒(Se)是第四周期第ⅥA族元素,是人体内不可或缺的微量元素,H2Se是制备新型光伏太阳能电池、半导体材料和金属硒化物的重要原料。
(1)已知:①2H2Se(g)+O2(g)![]() 2Se(s)+2H2O(l) ΔH1=akJ·mol-1
2Se(s)+2H2O(l) ΔH1=akJ·mol-1
②2H2(g)+O2(g)![]() 2H2O(l) ΔH2=bkJ·mol-1
2H2O(l) ΔH2=bkJ·mol-1
反应H2(g)+Se(s)![]() H2Se(g)的ΔH3=__kJ·mol-1(用含a、b的代数式表示)。
H2Se(g)的ΔH3=__kJ·mol-1(用含a、b的代数式表示)。
(2)T℃时,向一恒容密闭容器中加入3molH2和1molSe,发生反应H2(g)+Se(s)![]() H2Se(g)。
H2Se(g)。
①下列情况可判断反应达到平衡状态的是__(填字母代号)。
a.气体的密度不变 b.v(H2)=v(H2Se)
c.气体的压强不变 d.气体的平均摩尔质量不变
②当反应达到平衡后,将平衡混合气体通入气体液化分离器使H2Se气体转化为H2Se液体,并将分离出的H2再次通入发生反应的密闭容器中继续与Se反应时,Se的转化率会提高。请用化学平衡理论解释:_。
③以5小时内得到的H2Se为产量指标,且温度、压强对H2Se产率的影响如图1、图2所示:
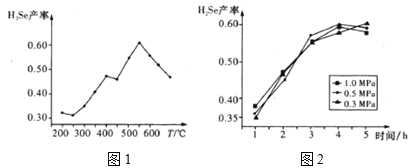
则制备H2Se的最佳温度和压强为__。
(3)已知常温下H2Se的电离平衡常数K1=1.3×10-4、K2=5.0×10-11,则NaHSe溶液呈__(填“酸性”或“碱性”),请通过计算数据说明__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将0.10mol·L-1的NaOH溶液滴加到10.00mL0.10mol·L-1HX溶液中,所得滴定曲线如图,已知HX的电离平衡常数为1.0×10-9,下列说法错误的是( )

A.①处pH约为5
B.②处pH一定大于7
C.水的电离程度:③>纯水>②
D.②中离子浓度大小关系:c(Na+)>c(X-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铁铵(NH4Fe(SO4)2·xH2O)是一种重要铁盐,为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁氨,具体流程如下:

(1)步骤②需要加热的目的是_______________
(2)步骤②温度保持80-95℃,采用的合适加热方式是_____________________
(3)步骤③加入5%H2O2的目的是将Fe2+全部氧化为Fe3+,不引入杂质,请写出反应的离子方程式__________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硅晶体是立体的网状结构,其结构如图所示.关于二氧化硅晶体的下列说法不正确的是( )
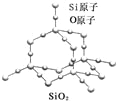
A. 晶体中Si、O原子个数比为1:2
B. 晶体中Si、O原子最外层都满足8电子结构
C. 晶体中一个硅原子含有Si﹣O键数目为4
D. 晶体中最小环上的原子数为6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳钢广泛应用在石油化工设备管道等领域,随着深层石油天然气的开采,石油和天然气中含有的CO2及水引起的腐蚀问题(俗称二氧化碳腐蚀)引起了广泛关注。深井中二氧化碳腐蚀的主要过程如下所示:
负极:![]() (主要)
(主要)
正极:![]() (主要)
(主要)
下列说法不正确的是
A.钢铁在CO2水溶液中的腐蚀总反应可表示为![]()
B.深井中二氧化碳对碳钢的腐蚀主要为化学腐蚀
C.碳钢管道在深井中的腐蚀与油气层中盐份含量有关,盐份含量高腐蚀速率会加快
D.腐蚀过程表明含有CO2的溶液其腐蚀性比相同pH值的HCl溶液腐蚀性更强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二次电池充放电时总反应可表示为Fe+Ni2O3+3H2O![]() Fe(OH)2+2Ni(OH)2,下列说法正确的是( )
Fe(OH)2+2Ni(OH)2,下列说法正确的是( )
A.该电池可用H2SO4溶液作电解液
B.放电时,当有1molFe(OH)2生成时,电解质溶液中通过的电子数为2NA
C.放电时,Fe所在的电极发生还原反应
D.充电时,阳极的电极反应式为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com