
| A、氧化性比较:S2O82->MnO4- |
| B、氧化剂S2O82-的摩尔质量为192g/mol |
| C、该反应中酸性介质可以为盐酸 |
| D、若有0.1mol氧化产物生成,则转移电子0.5mol |


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
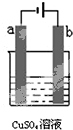 如图为直流电源电解1L 0.2mol/L的CuSO4水溶液的装置.通电一段时间后,b电极共收集到4.48L的气体(标准状况下),然后在石墨电极a和b附近分别滴加一滴石蕊试液,下列关于实验的叙述中不正确的是( )
如图为直流电源电解1L 0.2mol/L的CuSO4水溶液的装置.通电一段时间后,b电极共收集到4.48L的气体(标准状况下),然后在石墨电极a和b附近分别滴加一滴石蕊试液,下列关于实验的叙述中不正确的是( )| A、a电极的产物有Cu和H2 |
| B、反应一段时间后,溶液的pH值变小 |
| C、a电极附近呈红色,b电极附近出现蓝色 |
| D、a、b电极转移的电子数为0.8mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O2用作呼吸面具的供氧剂 |
| B、工业上电解熔融状态Al2O3制备Al |
| C、工业上利用合成氨实现人工固氮 |
| D、实验室制二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol?L-1 AlC13溶液中:H+、Na+、Cl-、SO42- |
| B、含有0.1mol?L-1 Fe3+的溶液中:Na+、K+、SCN-、NO3- |
| C、使甲基橙变红色的溶液中:Fe2+、K+、NO3-、SO42- |
| D、由水电离产生的c(H+)=10-12 mol?L-1的溶液中:NH4+、SO42-、HCO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子序数X>Y |
| B、最外层电子数X>Y |
| C、原子半径X<Y |
| D、最高正价X<Y |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同周期元素中,VⅡA族元素的原子半径最大 |
| B、现已发现的零族元素的单质在常温常压下都是气体 |
| C、ⅥA族元素的原子,其半径越大,越容易得到电子 |
| D、所有的主族元素的简单离子的化合价与其族序数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向苯酚钠溶液中通入少量的CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3- | ||||
| B、AlCl3溶液中加入少量氨水:Al3++3OH-=Al(OH)3↓ | ||||
| C、(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-=Fe(OH)2↓ | ||||
D、用惰性电极电解氯化钠溶液:2Cl-+2H+
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com