
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案科目:高中化学 来源:2016届安徽省合肥市高三上学期期中考试化学试卷(解析版) 题型:选择题
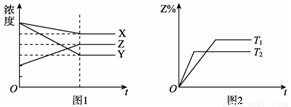
在一个容积为2L的密闭容器中,加入0.8molA2气体和0.6molB2气体,一定条件下发生如下反应:A2(g)+ B2(g)====2AB(g)ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说明不正确的是 ( )
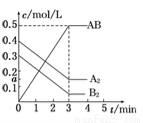
A.图中a点的值为0.15
B.该反应的平衡常数K=0.03
C.温度升高,平衡常数K值减小
D.平衡时A2的转化率为62.5%
查看答案和解析>>
科目:高中化学 来源:2015-2016学年贵州省高二上二次月考化学试卷(解析版) 题型:选择题
在某一容积为2 L的密闭容器中,加入0.2 mol的CO和0.2 mol的H2O,在催化剂存在的条件下,高温加热,发生如下反应:CO(g)+H2O(g) CO2(g)+H2(g) ΔH=—a kJ/mol(a>0),反应达平衡后,测得c(CO)∶c(CO2)=3∶2,下列说法正确的是
CO2(g)+H2(g) ΔH=—a kJ/mol(a>0),反应达平衡后,测得c(CO)∶c(CO2)=3∶2,下列说法正确的是
A.反应放出的热量为0.04a kJ
B.若将容器的体积压缩为1 L,有利于该平衡正向移动
C.平衡时H2O的转化率为40%
D.CO、H2O、CO2、H2的浓度都相等时反应达到平衡
查看答案和解析>>
科目:高中化学 来源:2016届云南师大附属中学高三上适应性月考理综化学试卷(解析版) 题型:填空题
硫及其化合物有广泛应用。
(l)硫酸生产过程中涉及以下反应。已知25℃、10lkPa时:
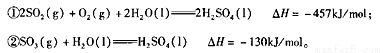
则SO2催化氧化为SO3(g)的热化学方程式为
(2)对于SO2催化氧化为SO3的反应。
①图甲是SO2(g)和SO3(g)的浓度随时间t的变化情况。反应从开始到达到平衡时,用O2表示的平均反应速率为
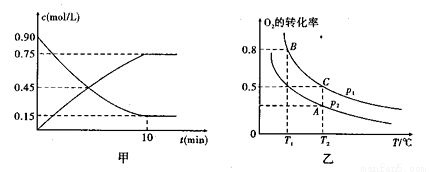
②在一容积可变的密闭容器中充入20mol SO2(g)和10mol O2(g),O2的平衡转化率随温度(T)、压强(p)的变化如图乙所示。则p1与p2的大小关系是p1 p2:(填“>”“<”或“=”);A、B、C三点的平衡常数大小关系为 (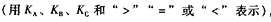 ),理由是
),理由是
(3)工业生产硫酸过程中,通常用氨水吸收尾气
①如果在25℃时,相同物质的量的SO2与NH3溶于水,发生反应的离子方程式为
所得溶液中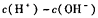 = (填序号)。
= (填序号)。
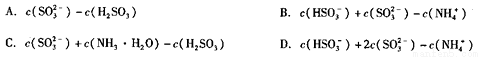
②已知在25℃时NH3·H2O、H2SO3电离平衡常数如下表,则上述所得溶液中,各离子浓度由大到小的顺序为

查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二上期中测试化学试卷(解析版) 题型:选择题
(改编)为了测定酸碱反应的中和热,计算时至少需要的数据是
①酸的浓度和体积;②碱的浓度和体积;③比热容;④反应后溶液的质量;⑤生成水的质量;⑥前后温度的变化;⑦操作所需时间
A.①②④⑥ B.③④⑤⑥ C.①③④⑤ D.全部
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁实验中学分校高二上12月月考化学卷(解析版) 题型:填空题
下图为苯和溴的取代反应的改进实验装置图。其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入铁屑粉少量。
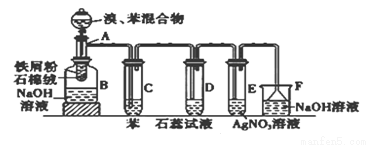
填写下列空白:(注:溴苯与NaOH溶液不可以发生水解反应)
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应。写出A中所有反应的化学方程式___________________________。
(2)试管C中苯的作用是________________;反应开始后,观察D和E试管,看到的现象为D中___________;E中 ;
(3)在上述整套装置中,具有防倒吸的仪器有___________________(填字母)
(4)改进后的实验除①步骤简单,操作方便,成功率高;②各步现象明显;③对产品便于观察这3个优点外,还有一个优点是_______________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高二上12月月考化学试卷(解析版) 题型:选择题
已知298K时,Mg(OH)2的溶度积常数KSP=5.6×10-12,取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=13.0,则下列说法不正确的是
A.所得溶液中的c(H+)=10-13 mol/L
B.所加烧碱溶液的pH=13.0
C.所得溶液中由水电离出的c(OH-)=10-13 mol/L
D.所得溶液中的c(Mg2+)=5.6×10-10 mol/L
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高二上期中测试化学试卷(解析版) 题型:填空题
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁
已知:
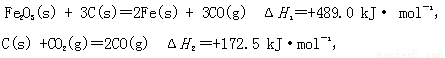
则CO 还原Fe2O3(s)的热化学方程式为 。
(2)尾气中的CO 主要来自于汽油不完全燃烧。有人设想按下列反应除去CO:
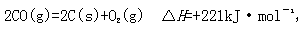 ,简述该设想能否实现的依据: 。
,简述该设想能否实现的依据: 。
(3)CO2 和H2 充入一定体积的密闭容器中,在两种温度下发生反应: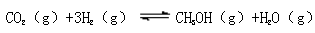
测得CH3OH 的物质的量随时间的变化如图所示。

①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ KⅡ(填“>”或“=”或“<”)。
②一定温度下,此反应在恒.压.容器中进行,能判断该反应达到化学平衡状态的依据是 。
a.容器中压强不变b.H2 的体积分数不变
c.c(H2)=3c(CH3OH) d.容器中密度不变
e.2 个C=O 断裂的同时有6 个H-H 断裂
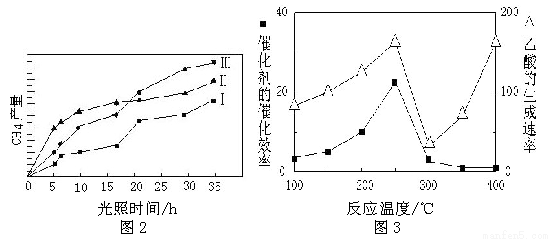
(4)利用光能和光催化剂,可将CO2 和H2O(g)转化为CH4 和O2。紫外光照射时,在不同催化剂(I、II、III)作用下,CH4 产量随光照时间的变化如下图2。在0~15 小时内,CH4 的平均生成速率I、II 和III 从小到大的顺序为 (填序号)。
(5)以TiO2/Cu2Al2O4 为催化剂,可以将CO2 和CH4 直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系如下图3:
①当温度在 范围时,温度是乙酸生成速率的主要影响因素。
②Cu2Al2O4难溶于水,可溶于浓硝酸并放出红棕色气体,写出反应的离子方程 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北航天高中、安陆二中等五校高二上期中化学试卷(解析版) 题型:选择题
符合下图的反应是
A.X+3Y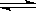 2Z ΔH>0 B.X+3Y
2Z ΔH>0 B.X+3Y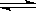 2Z ΔH<0
2Z ΔH<0
C.X+2Y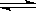 3Z ΔH<0 D.5X+3Y
3Z ΔH<0 D.5X+3Y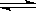 4Z ΔH<0
4Z ΔH<0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com