
下列有关物质性质的比较顺序中,不正确的是( )
|
| A. | 热稳定性:HF>HCl>HBr>HI |
|
| B. | 微粒半径:K+>Na+>Mg2+>Al3+ |
|
| C. | 酸性:HClO4>H2SO4>H3PO4>H2SiO3 |
|
| D. | 熔点:金刚石>Hg>KCl>HCl |
考点:
非金属在元素周期表中的位置及其性质递变的规律;微粒半径大小的比较;晶体的类型与物质熔点、硬度、导电性等的关系.
专题:
元素周期律与元素周期表专题.
分析:
A.同主族元素从上到下元素的非金属性逐渐减弱,对应的氢化物的稳定性逐渐减弱;
B.根据离子核外电子层数的多少以及电子层数与核电核数的关系判断;
C.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
D.一般来说熔点原子晶体>离子晶体>金属晶体>分子晶体.
解答:
解:A.同主族元素从上到下元素的非金属性逐渐减弱,对应的氢化物的稳定性逐渐减弱,则非金属性:F>Cl>Br>I,所以稳定性:HF>HCl>HBr>HI,故A正确;
B.K+核外有3个电子层,离子半径最大,Na+、Mg2+、Al3+离子核外电子排布相同,都有2个电子层,根据离子核电核数越大,半径越小可知Na+>Mg2+>Al3+,则有K+>Na+>Mg2+>Al3+,故B正确;
C.已知非金属性:Cl>S>P>Si,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,则有酸性:HClO4>H2SO4>H3PO4>H2SiO3,故C正确;
D.Hg常温下为液体,熔点比KCl低,故D错误.
故选D.
点评:
本题考查元素周期律知识,为高频考点,题目难度不大,本题注意把握元素周期律与元素周期表的关系,注重相关规律、方法的把握.


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
1)AgNO3的水溶液呈 (填“酸”、“中”、“碱”)性,实验室在配制AgNO3溶液时, 常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,浓的硝酸以 (填“促进”、“抑制”)其水解。
(2)氯化铝水溶液呈 性 ,原因是____ ___________________________;(用离子方程式表示):
___________________________;(用离子方程式表示):
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 _______ 。(用化学式表示)
(3)在配制硫化钠溶液时,为了防止发生水解,可以加入少的 _______。
原因是: _______________________________________________ (用离子方程式表示) 。
(4)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成 沉淀 (填化学式),生成该沉淀的离子方程式为 。
(已知25℃时Ksp[Mg(OH)2]=1.8×10- 11,KsP[Cu(OH)2]=2.2×10-20)
11,KsP[Cu(OH)2]=2.2×10-20)
查看答案和解析>>
科目:高中化学 来源: 题型:
某高聚物的结构如图: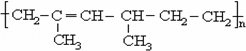 其单体的名称为( )
其单体的名称为( )
A.2,4﹣二甲基﹣2﹣已烯
B.2﹣甲基﹣1,3﹣戊二烯和乙烯
C.2﹣甲基﹣1,3﹣丁二烯和丙烯
D.2,4﹣二甲基﹣1,3﹣已二烯和乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质发生状态变化所克服的微粒间的相互作用属于同种类型的是( )
|
| A. | 食盐和蔗糖溶于水 | B. | 钠和硫熔化 |
|
| C. | 碘和干冰升华 | D. | 二氧化硅和氧化钠熔化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某离子化合物的晶体中,最小重复单元及其八分之一结构单元如图所示,具有该晶体结构的化合物可能是( )
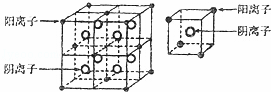
|
| A. | CaF2 | B. | CO2 | C. | NaCl | D. | CsCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
如图表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚 石、石墨结构中的某一种的某一部分.
(1)其中代表金刚石的是(填编号字母) ,
(2)其中表示NaCl的是(填编号字母) ,
(3)代表CsCl的是 ,它属于 晶体,
(4)代表干冰的是(填编号字母) ,它属于 晶体,
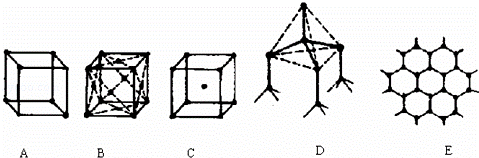
查看答案和解析>>
科目:高中化学 来源: 题型:
对于mA(s) + nB(g)  eC(g) + f D(g),反应过程中,当其它条件不变时,C的百分含量(C%)和压强(P)的关系如图,下列叙述正确的是
eC(g) + f D(g),反应过程中,当其它条件不变时,C的百分含量(C%)和压强(P)的关系如图,下列叙述正确的是
 A.达到平衡后,加入催化剂,则C%增大
A.达到平衡后,加入催化剂,则C%增大
B.达到平衡后,若升温,平衡逆向移动
C.化学方程式中n<e +f
D.达到平衡后,增加A的量,平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭容器中加入A和B,各物质的物质的量浓度随着反应的进行,如图所示。下列说法不正确的是

A.该反应的化学方程式为5A+4B 4C
4C
B.2min时,该反应达到平衡,此时A、B、C的浓 度比为5:4:4
度比为5:4:4
C.用B的浓度变化表示0-2min时间内的速率为2mol/(L·min)
D.2min前,正反应速率逐渐减小,逆反应速率逐渐增大,但是正反应速率大于逆反应速率。
查看答案和解析>>
科目:高中化学 来源: 题型:
两瓶不同浓度的氢氧化钠溶液各取100ml,分别通入CO2 2.24L(标准状况)。完全反应后,将溶液低温缓慢蒸干,分别得到不含结晶水的固体10.0g、11.6g,判断这两种固体的组成成分,并计算原两瓶氢氧化钠溶液的物质的量浓度各是多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com