
【题目】高铁电池是一种新型电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为![]()
![]() ,下列叙述正确的是( )
,下列叙述正确的是( )
A.放电时正极附近溶液的碱性增强
B.放电时每转移3mol电子,正极有1mol ![]() 被氧化
被氧化
C.放电时正极反应为:![]()
D.该原电池,Zn作正极,可用石墨等作负极
科目:高中化学 来源: 题型:
【题目】常温下,用AgNO3溶液分别滴定浓度均为0.01 mol/L的KCl、K2C2O4溶液,所得的沉淀溶解平衡图像如图所示(不考虑C2O42-的水解)。下列叙述正确的是( )
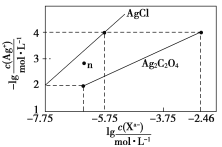
A.Ksp(Ag2C2O4)的数量级等于10-11
B.n点表示AgCl的不饱和溶液
C.向c(Cl-)=c(C2O42-)的混合液中滴入AgNO3溶液时,先生成Ag2C2O4沉淀
D.Ag2C2O4+2Cl-=2AgCl+C2O42-的平衡常数为109.04
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲胺(CH3NH2)是一种一元弱碱,其电离方程式为:CH3NH2 + H2O ![]() CH3NH3+ + OH-。常温下,向20.0 mL 0.10 mol/L的甲胺溶液中滴加VmL0.10mol/L的稀盐酸,混合溶液的pH与相关微粒浓度的关系如图所示。下列说法中错误的是
CH3NH3+ + OH-。常温下,向20.0 mL 0.10 mol/L的甲胺溶液中滴加VmL0.10mol/L的稀盐酸,混合溶液的pH与相关微粒浓度的关系如图所示。下列说法中错误的是

A. b点对应加入盐酸的体积V<20.00mL
B. 常温下,根据a点可知甲胺的电离平衡常数Kb=10 -3.4
C. b点可能存在关系:c(Cl-) > c(CH3NH3+) > c(H+) = c(OH-)
D. V=20.00mL时,溶液呈弱酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿水青山就是金山银山,保护环境人人有责。直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。吸收液吸收SO2的过程中,pH随n(Na2SO3):n(NaHSO3)变化关系如下表:
n(Na2SO3):n(NaHSO3) | 91:9 | 1:1 | 9:91 |
pH | 8.2 | 7.2 | 6.2 |
(1)由上表判断NaHSO3溶液显_____性。
(2)pH=8.2的吸收液中由水电离出的c(OH-)______0.1molL-1NaOH溶液中由水电离出来的c(OH-)(填“>”、“<”或“=”)。
(3)将pH=8.2的吸收液蒸干得到固体的主要成分是______。
(4)25℃时,当吸收液为中性时,溶液中离子浓度关系正确的是______(选填字母)。
A. c(Na+)=2c(SO32-)+c(HSO3-)
B .c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
C. c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(5)氮的氢化物之一肼(N2H4)-空气燃料电池是一种环保型碱性燃料电池,电解质溶液是20%-30%的KOH溶液,负极的电极反应式是_______________,若使用该电池做电源,惰性电极电解500mL 1mol/L的CuSO4溶液,一段时间后溶液的PH=1,消耗的N2H4质量为_________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烯是一种重要的化工原料,可采用乙苯催化脱氢法制备,反应如下: ![]() (g)
(g)![]()
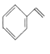 (g)+H2(g) △H=+17.6kJ/mol。
(g)+H2(g) △H=+17.6kJ/mol。
(1)从温度和压强角度分析提高乙苯平衡转化率可采取的措施有___________。
(2)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1:4),测得容器总压和乙苯转化率随时间变化结果如图所示。
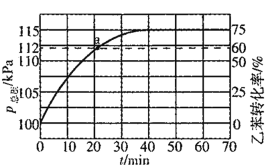
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实__________。
平衡常数Kp=_______kPa(Kp为以分压表示的平衡常数)
②反应速率V=V正-V逆=k正P乙苯-k逆p苯乙烯p氢气,k正、k逆分别为正逆反应速率常数。计算a处的![]() ______。
______。
(3)CO2气氛下乙苯催化脱氢可同时存在图1两种途径:
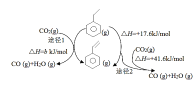
①b=_______kJ/mol。
②途径I的反应历程图所示,下列说法正确的是______________。
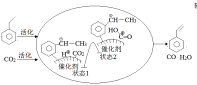
a.CO2为氧化剂
b.状态1到状态2形成了O-H键
c.中间产物只有(![]() )
)
d.该催化剂可提高乙苯的平衡转化率
③在相同的容器中,不同p(CO2)的条件下,进行相同的反应时间,p(CO2)与乙苯转化率关系如图,分析,p(CO2)为15kPa时乙苯转化率最高的因____________________。
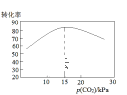
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种废料的主要成分是铁镍合金,还含有铜、钙、镁、硅的氧化物,由该废料制备的纯度较高的氢氧化镍,工艺流程如下,已知常温下Ksp[Ni(OH)2]=1.0×10-15,则下列说法错误的是( )
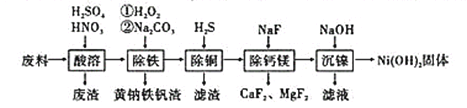
A. 废渣中含有二氧化硅和硫酸钙
B. 加热煮沸可以提高除铁效率
C. 除铜过程中,溶液酸性增强
D. “沉镍”过程中为了将镍沉淀完全,需要调节pH>9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S可用于制造硫化染料、沉淀水体中的重金属等。
(1)Na2S溶液中S2-水解的离子方程式为_________。
(2)室温时,几种重金属离子的硫化物的溶度积常数如下表:
金属硫化物 | FeS | PbS | CuS | HgS |
Ksp | 6.3×10-18 | 1.0×10-28 | 6.3×10-36 | 1.6×10-52 |
①向物质的量浓度相同的Fe2+、Pb2+、Cu2+、Hg2+的混合稀溶液中,逐滴加入Na2S稀溶液,首先沉淀的离子是____。
②用Na2S溶液沉淀废水中Pb2+,为使Pb2+沉淀完全[c(Pb2+)≤1×10-6mol/L],则应满足溶液中c(S2-)≥_____mol/L。
③反应Cu2+(aq)+FeS(s)![]() Fe2+(aq)+CuS(s)的平衡常数K=_______。
Fe2+(aq)+CuS(s)的平衡常数K=_______。
(3)测定某Na2S和NaHS混合样品中两者含量的实验步骤如下:
步骤1.准确称取一定量样品于烧杯中,加入少量蒸馏水溶解,转移至500mL容量瓶中定容。
步骤2.准确移取25.00mL上述溶液于锥形瓶中,加入茜素黄GG-百时香酚蓝混合指示剂,用0.2500mol/L盐酸标准溶液滴定(Na2S+HCl=NaHS+NaCl)至终点,消耗盐酸24.00mL;向其中再加入5mL中性甲醛(NaHS+HCHO+H2O→NaOH+HSCH2OH)和3滴酚酞指示剂,继续用0.2500mol/L盐酸标准溶液滴定(NaOH+HCl=NaCl+H2O)至终点,又消耗盐酸34.00mL。
计算原混合物中Na2S与NaHS的物质的量之比(写出计算过程)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)在实验室中,![]() 可用铁粉和______反应制备,
可用铁粉和______反应制备,![]() 可用铁粉和______反应制备。
可用铁粉和______反应制备。
(2)黄铁矿![]() 主要成分为
主要成分为![]() 是生产硫酸和冶炼钢铁的重要原料。高温下可发生反应:
是生产硫酸和冶炼钢铁的重要原料。高温下可发生反应:
![]() ,该过程中若有
,该过程中若有![]()
![]() 参加反应,则反应过程中转移______mol电子。
参加反应,则反应过程中转移______mol电子。
(3)![]() 与Zn组成新型二次电池高铁电池,电解液为碱溶液,其反应式为:
与Zn组成新型二次电池高铁电池,电解液为碱溶液,其反应式为:![]() ,放电时电池的负极反应式为______;充电时电解液的pH______
,放电时电池的负极反应式为______;充电时电解液的pH______![]() 填“增大”“减小”或“不变”之一
填“增大”“减小”或“不变”之一![]() 。
。
(4)某同学向盛有![]() 溶液的试管中加入几滴酸化的
溶液的试管中加入几滴酸化的![]() 溶液,溶液变成棕黄色,发生反应的离子方程式为______;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成。产生气泡的原因是______;生成沉淀的原因是______
溶液,溶液变成棕黄色,发生反应的离子方程式为______;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成。产生气泡的原因是______;生成沉淀的原因是______![]() 用平衡移动原理解释
用平衡移动原理解释![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合理利用资源,降低碳的排放,实施低碳经济是今后经济生活主流方向。
(1)下列措施不利于有效减少二氧化碳排放的是________。
A.植树造林,保护森林,保护植被
B.加大对煤和石油的开采,并鼓励使用石油液化气
C.推广使用节能灯和节能电器,使用空调时夏季温度不宜设置过低,冬天不宜过高
D.倡导出行时多步行和骑自行车,建设现代物流信息系统,减少运输工具空驶率
(2)CO2合成生产燃料甲醇(CH3OH)是碳减排的新方向。进行如下实验:某温度下在1 L的密闭容器中,充2 mol CO2和6 mol H2,发生:CO2(g)+3H2(g )![]() CH3OH(g)+H2O(g),现测得CO2和CH3OH(g)的浓度随时间变化如下图1所示。从反应开始到平衡时CO2的转化率为_________。氢气的平均反应速率v(H2)=_______mol/(L·min)。该温度下的平衡常数为________。
CH3OH(g)+H2O(g),现测得CO2和CH3OH(g)的浓度随时间变化如下图1所示。从反应开始到平衡时CO2的转化率为_________。氢气的平均反应速率v(H2)=_______mol/(L·min)。该温度下的平衡常数为________。
(3)CO在催化作用下生成甲醇:CO(g)+2H2(g)![]() CH3OH(g)。已知密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率(α)与温度、压强的关系如图所示。
CH3OH(g)。已知密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率(α)与温度、压强的关系如图所示。
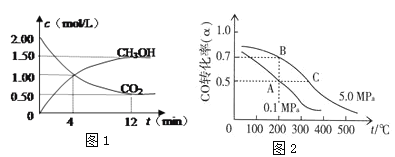
①该反应的ΔH_____0;ΔS____0。 (填“>、=、<”)
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA ____ tC(填“>、=、<”)
③A、B、C三点对应的平衡常数分别为KA、KB、KC,则的大小关系是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com