
铁及其化合物应用广泛。
(1)三氯化铁是一种水处理剂,工业制备无水三氯化铁固体的部分流程如下图:
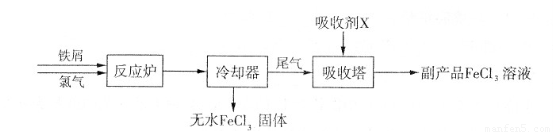
①检验副产品中含有X时,选用的试剂是??? (填下列各项中序号)。
a.NaOH溶液??? b.KSCN溶液? c.酸性KMnO4溶液? d、铁粉
②在吸收塔中,生成副产品FeCl。的离子方程式为
(2)高铁酸钾(K2FeO4)也是一种优良的水处理剂,工业上,可用铁作阳极,电解KOH溶液制备高铁酸钾。电解过程中,阳极的电极反应式为? ??? ? ;电解一段时间后,若阳极质量减少28 g,则在此过程中,阴极析出的气体在标准状况下的体积为??? L。
(3)硫化亚铁常用于工业废水的处理。
①你认为,能否用硫化亚铁处理含Cd2+的工业废水???? (填“能”或“否”)。请根据沉淀溶解平衡的原理解释你的观点(用必要的文字和离子方程式说明):??????????????????????????????????????????? (已知:25℃时,溶度积常数Ksp(FeS)=6.310-18、Ksp(CdS)=3.610-29)
②工业上处理含Cd2+废水还可以采用加碳酸钠的方法,反应如下:2Cd2++2CO32-+H2O=Cd2(OH)2CO3 +A。则A的化学式为?? ???? 。
+A。则A的化学式为?? ???? 。
(17分)
(1)(5分)①c(2分)②2Fe2++Cl2=2Fe3++2Cl?(3分)
(2)(5分)Fe—6e?+8OH?=FeO42?+4H2O(3分)33.6(2分)
(3)(7分)①能(1分)CdS比FeS更难溶,可发生沉淀转化Cd2+(aq)+FeS(s)=CdS(s)+Fe2+(aq)(3分)
?? ②CO2(3分)
【解析】
试题分析:(1)①吸收剂X的作用是吸收未反应的Cl2,生成FeCl3,所以X为FeCl2,检验FeCl3溶液中含有FeCl2的试剂是酸性KMnO4溶液,故c项正确。
②Fe作阳极失去电子生成FeO42?,用KOH溶液做电解质溶液,OH?参加反应,所以阳极电极方程式为:Fe—6e?+8OH?=FeO42?+4H2O;阴极和阳极得失电子总数相等,所以对应关系为:Fe ~ 6e? ~ 3H2 ,则n(H2)=3n(Fe)=3×28g÷56g/mol=1.5mol,标准状况下的体积为33.6L。
(3)①因为Ksp(CdS)小于Ksp(FeS),所以CdS比FeS更难溶,可发生沉淀转化Cd2+(aq)+FeS(s)=CdS(s)+Fe2+(aq),因此能用硫化亚铁处理含Cd2+的工业废水。
②根据元素守恒,可知A为CO2。
考点:本题考查化学工艺流程的分析、电解原理及计算、离子方程式的书写、沉淀溶解平衡。


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源:2012-2013学年陕西省宝鸡市高三第三次模拟理综化学试卷(解析版) 题型:填空题
在中学化学中铁及其化合物应用广泛,用所学知识回答下列问题。
(1)将一定量的铁粉在氯气中燃烧后所得固体溶于水可得到溶液X。取少量X溶液两份,一份加入KSCN溶液时,溶液显红色;另一份中加入酸性KMnO4溶液时,KMnO4溶液紫色褪去。试分析:
①溶液X含有的金属阳离子应该是 。
②用化学方程式表示上述金属阳离子产生的原因 。
③酸性KMn04溶液紫色褪去的离子方程式为 。
(2)含铬化合物有毒,通常是将废水中+6价铬(如Cr2O2—7)用还原剂还原成Cr3+,再调节溶液pH使Cr3+转化为Cr(OH)3沉淀而除去。工业上有一种电解除Cr2O2—7的方法:将含K2Cr2O7的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解。
试分析该电解除Cr2O2—7的方法中:
①阴极的电极反应式为 ;
②电解时加入氯化钠的作用是 ;
③该方法能除去Cr2O2—7的原理是 。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2AlN+3CO.该反应中每生成2mol AlN,N2得到______mol电子.
2AlN+3CO.该反应中每生成2mol AlN,N2得到______mol电子.查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com