
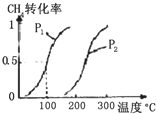
 甲醇被称为21世纪的新型燃料,工业上用CH4和H2O为原料通过下列反应①和②,来制备甲醇.
甲醇被称为21世纪的新型燃料,工业上用CH4和H2O为原料通过下列反应①和②,来制备甲醇.| 实验编号 | T(°C) | n(CO)/n(H2) | p(MPa) | ||
| I | 150 |
|
0.1 | ||
| II | 5 | ||||
| III | 350 | 5 |
| 1 |
| 2 |
| c(CO)×c3(H2) |
| c(CH4)×c(H2O) |
| c(CO)×c3(H2) |
| c(CH4)×c(H2O) |
(
| ||||
(
|
| 1 |
| 3 |
| 1 |
| 3 |
| 1 |
| 3 |
| 1 |
| 3 |
| 点燃 |
| ||


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
| A、漂白粉露置在空气中失效:ClO-+CO2+H2O=HClO+HCO3- |
| B、向NaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- |
| C、向Na2S2O3溶液中通入足量氯气:S2O32-+2Cl2+3H2O=2SO32-+4Cl-+6H+ |
| D、在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+Fe(OH)3=FeO42-+3Cl-+H2O+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 CO和H2的混合气体俗称合成气,是一种重要的工业原料气,可以在一定条件下制备甲醇,二甲醚等多种有机物.工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气.
CO和H2的混合气体俗称合成气,是一种重要的工业原料气,可以在一定条件下制备甲醇,二甲醚等多种有机物.工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气.| 时间/min 物质 浓度 |
0 | 1 | 2 | 3 | 4 |
| CH4 | 0.2mol?L-1 | 0.13mol?L-1 | 0.1mol?L-1 | 0.1mol?L-1 | 0.09mol?L-1 |
| H2 | 0mol?L-1 | 0.2mol?L-1 | 0.3mol?L-1 | 0.3mol?L-1 | 0.33mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
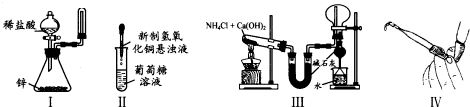
| A、实验I:制取并收集氢气 |
| B、实验II:验证葡萄糖的还原性 |
| C、实验III:实验室制氨气并收集干燥的氨气 |
| D、实验Ⅳ:检查碱式滴定管是否漏液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 所需数据取值范围 | 生成CO2气体的体积 | |
| 盐酸不足量时 | ||
| 盐酸足量时 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1molNa2O2和水完全反应,转移电子数为2nA |
| B、0.5L0.2mol?L-1FeCl3溶液中,含Fe3+离子数为0.1nA |
| C、理论上氢氧燃料电池负极消耗11.2L标准状况下气体,外线路通过电子数为nA |
| D、常温常压下,28g乙烯和丙烯混合气体含有的碳原子总数为2.5nA |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、氢氧化钡溶液与稀硫酸:Ba2++2OH-+2H++SO
| ||
B、Al2(SO4)3浴液中加入足量氨水:Al3++3NH3?H2O=Al(OH)3↓+3NH
| ||
| C、FeBr2溶液中通入过量Cl2 2Fe2++6Br-+4Cl2=2Fe3++3Br2+8Cl- | ||
| D、Fe2O3溶于过量的盐酸中:Fe2O3+6H+=2Fe3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、23 g钠在氧气中完全燃烧失去电子数为NA |
| B、标准状况下,22.4L已烷所含碳原子数为6NA |
| C、20℃、1.01×105Pa时,1.6gC2H4和1.2g CO的混合气体,含气体分子数为0.1NA |
| D、0.1L 3mol?L-1的Al2(SO4)3溶液中含有的Al3+数目为0.6NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com