
| A、碳酸氢铵和足量的氢氧化钠溶液反应:NH4++OH-=NH3↑+H2O | ||||
| B、含等物质的量的硫酸氢钠与氢氧化钡两溶液混合:H++SO42-+Ba2++OH-=BaSO4↓+H2O | ||||
| C、用稀硝酸浸泡做过银镜反应的试管:3Ag+4H++NO3-=3Ag++NO↑+2H2O | ||||
D、用两个铜电极电解饱和食盐水:2Cl-+2H2O
|
| ||


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
| A、2.5 mol |
| B、2 mol |
| C、1 mol |
| D、5 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
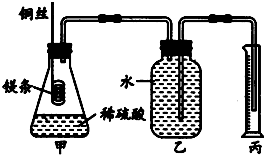 化学兴趣小组设计测定镁原子的摩尔质量的实验,简易装置如图,除去表面氧化膜的镁条质量为0.24g,镁条完全反应后,用量筒收集水,体积为0.224L(设已折换成标准状况下的对应的气体体积).
化学兴趣小组设计测定镁原子的摩尔质量的实验,简易装置如图,除去表面氧化膜的镁条质量为0.24g,镁条完全反应后,用量筒收集水,体积为0.224L(设已折换成标准状况下的对应的气体体积).查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将少量CO2气体通入NaClO溶液中;H++ClO-=HClO |
| B、在氯水中滴入少量NaOH溶液:Cl2+2OH-=Cl-+2HClO |
| C、在Ca(HCO3)2溶液中滴入过量NaOH溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O |
| D、在AgF溶液中滴入盐酸:Ag++F-+H++Cl-=AgCl↓+HF |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.5×10-2 |
| B、0.25 |
| C、4.0 |
| D、4.0×102 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com