
| A. | CH3CH=C(CH3) CH3 3-甲基-2-丁烯 | |
| B. | CH3CH(CH3)CH(Cl)CH3 3-甲基-2-氯丁烷 | |
| C. | CH3CH(OH)CH2CH3 2-羟基丁醇 | |
| D. | CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷 |
分析 A、烯烃命名选取含有碳碳双键的最长碳链,距离双键最近的一端为1号碳;
B、烷烃的命名遵循长、多、近、小、简原则;
C、醇类命名选取含有羟基的最长碳链,距离羟基最近的一端为1号碳;
D、烷烃的命名中出现2-乙基,说明选取不是最长碳链.
解答 解:A.CH3CH=C(CH3) CH3 3-甲基-2-丁烯,甲基的编号错误,正确命名应该为:2-甲基-2-丁烯,故A错误;
B.CH3CH(CH3)CH(Cl)CH3,该有机物为氯代烃,正确命名应该为:3-甲基-2-氯丁烷,故B正确;
C.CH3CH(OH)CH2CH3 2-羟基丁醇,该有机物为醇类,醇类命名中不出现“羟基”,正确命名为2-丁醇,故C错误;
D.CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷,烷烃的命名中出现2-乙基,说明选取的主链不是最长碳链,该有机物正确命名应该为:3-甲基己烷,故D错误;
故选B.
点评 本题考查了有机物的命名,题目难度不大,该题注重了基础性试题的考查,侧重对学生基础知识的检验和训练,该题的关键是明确有机物的命名原则,然后结合有机物的结构简式灵活运用即可,有利于培养学生的规范答题能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定温度和压强下,各种气态物质体积的大小,由构成气体的分子大小决定. | |
| B. | 气体摩尔体积是指1摩尔任何气体所占的体积约为22.4L. | |
| C. | 不同的气体,若体积不同,则它们所含的分子数也不同 | |
| D. | 一定温度和压强下,各种气态物质体积的大小,由构成气体的分子数决定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 主要玻璃仪器 | 试剂 |
| A | 鉴别Na2CO3和NaHCO3溶液 | 试管、胶头滴管 | 澄清石灰水 |
| B | 分离I2和CCl4的混合物 | 分液漏斗、烧杯 | 乙醇 |
| C | 实验室制取干燥的NH3 | 试管、酒精灯、带导管的橡皮塞 | NH4Cl、Ca(OH)2、碱石灰 |
| D | 测定NaOH溶液的浓度 | 滴定管、锥形瓶、烧杯 | NaOH溶液、酚酞试剂、0.1000mol•L-1盐酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 它既不溶于水,也不溶于NaHCO3溶液.能够跟1mol该化合物起反应的H2或HBr的最大用量分别是( )
它既不溶于水,也不溶于NaHCO3溶液.能够跟1mol该化合物起反应的H2或HBr的最大用量分别是( )| A. | 1mol﹑2mol | B. | 4mol﹑4mol | C. | 4mol﹑2mol | D. | 4mol﹑1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 叠氮化钠(NaN3)是一种无色晶体,常见的两种制备方法为:
叠氮化钠(NaN3)是一种无色晶体,常见的两种制备方法为: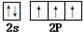 .
.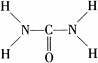 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9gD2O中含有的电子数为5NA | |
| B. | 4.5gSiO2晶体中含有的硅氧键的数目为0.15NA | |
| C. | 1molCH4分子中共价键总数为4NA | |
| D. | 7.1g C12与足量NaOH溶液反应转移的电子数为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com