【答案】
分析:(1)根据温度计、量筒、滴定管的刻度特征辨析;温度计、量筒的精确度为0.1,滴定管的精确度为0.01.
(2)①天平平衡原理为左盘内质量等于右盘内质量加游码质量;
②根据滴定终点的pH要在指示剂的变色范围之内确定指示剂;
根据指示剂在不同的酸碱性溶液显示不同的颜色判断.
③氢氧化钠溶液的体积取3次平均值,邻苯二甲酸氢钾,分子内有1个羧基,所以邻苯二甲酸氢钾与氢氧化钠按1:1反应,由此计算.
④根据氢氧化钠溶液浓度的表达式c(NaOH)=

具体分析.
A、未用氢氧化钠溶液洗涤碱式滴定管,使氢氧化钠溶液浓度减小,相同质量的邻苯二甲酸氢钾需要氢氧化钠溶液体积增多;
B、滴定前平视,滴定后俯视读数,氢氧化钠溶液的体积读数变小;
C、滴定前滴定管尖嘴有气泡,滴定后气泡消失,一部分氢氧化钠溶液存留在尖嘴内没有参加反应,计算时这部分氢氧化钠溶液按参加反应计算;
D、如果滴定前用邻苯二甲酸氢钾溶液洗锥形瓶,邻苯二甲酸氢钾的量增多,消耗的氢氧化钠溶液体积增多.
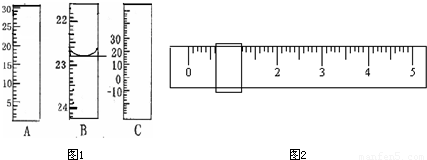
解答:解:(1)滴定管的刻度由上向下增大,量筒的刻度由下向上增大,且不标“0”刻度,温度计由负刻度,故A仪器是量筒,B是滴定管,精确度为0.01,如图所示读数为22.80ml.
故答案为:量筒; 22.80
(2)①未用砝码,所以游码的读数即为邻苯二甲酸氢钾的质量,由图可知其质量为0.6g.
故答案为:0.6
②邻苯二甲酸氢钾为弱酸,终点时溶液的pH约为9.1,滴定终点的pH要在指示剂的变色范围之内,所以选用酚酞作指示剂,酚酞在pH<8时为无色,pH为8~10之间,呈浅红色,所以当无色溶液变成浅红色,且半分钟内不褪色,说明反应到终点.
故答案为:酚酞;无色溶液变成浅红色,且半分钟内不褪色
③邻苯二甲酸氢钾,分子内有1个羧基,所以邻苯二甲酸氢钾与氢氧化钠按1:1反应,即邻苯二甲酸氢钾与氢氧化钠的物质的量相等,所以氢氧化钠溶液物质的量浓度为c(NaOH)=

.
故答案为:c(NaOH)=

④A、相同质量的邻苯二甲酸氢钾需要氢氧化钠溶液体积增多,所以NaOH溶液浓度偏低,故A错误;
B、滴定前平视,滴定后俯视读数,氢氧化钠溶液的体积读数变小,所以NaOH溶液浓度偏高,故B正确;
C、滴定前滴定管尖嘴有气泡,滴定后气泡消失,一部分氢氧化钠溶液存留在尖嘴内没有参加反应,计算时这部分氢氧化钠溶液按参加反应计算,所以所以NaOH溶液浓度偏低,故C错误;
D、不得用标准液或待测液润洗锥形瓶,操作正确,所测浓度为准确浓度,故D错误.
故选:B
点评:考查中和滴定、计量仪器及使用等,难度中等,根据所学知识进行解答,注意一些仪器的使用与结构.

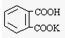 ,相对分子质量为204.0)是常用的基准物质.某学生用邻苯二甲酸氢钾测定未知NaOH溶液的浓度.在本实验中达到滴定终点时,溶液的pH约为9.1.
,相对分子质量为204.0)是常用的基准物质.某学生用邻苯二甲酸氢钾测定未知NaOH溶液的浓度.在本实验中达到滴定终点时,溶液的pH约为9.1. 具体分析.
具体分析. .
.


 名校课堂系列答案
名校课堂系列答案




