现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期.B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题:
(1)用元素符号表示B、C、D三种元素的第一电离能由低到高的顺序
.
(2)下列说法错误的是
.
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点:SiO
2>CO
2B.电负性顺序:C<N<O<F
C.N
2与CO为等电子体,化学性质相似
D.由于水分子间存在氢键,所以稳定性:H
2O>H
2S
(3)E元素的+2价氧化物的熔点比+3价氧化物(高或低),原因是
.
(4)B单质的一种同素异形体的晶胞如图1所示,若晶体的密度为ρ g/cm
3,阿伏加德罗常数的值为N
A,则晶体中最近的两个原子之间的距离为
cm.
(5)F离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点.
①F原子的外围电子排布式为
.向F的硫酸盐溶液中通入过量C与A形成的气体N,可生成[F(N)
4]
2+,该离子的结构式为
(用元素符号表示).
②某化合物与F(Ⅰ)(Ⅰ表示化合价为+1)结合形成图2所示的离子,该离子中碳原子的杂化方式有
.

 现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期.B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题:
现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期.B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题: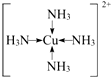 ,
, ;
;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 将气体甲通入液体乙中得一混合液,取一定质量的该混合液进行完全燃烧实验,生成CO2、H2O的质量与甲气体在混合液中质量分数关系如图所示,甲、乙组合正确的是( )
将气体甲通入液体乙中得一混合液,取一定质量的该混合液进行完全燃烧实验,生成CO2、H2O的质量与甲气体在混合液中质量分数关系如图所示,甲、乙组合正确的是( ) Ⅰ、下列是A、B、C、D、E五种短周期元素的某些性质
Ⅰ、下列是A、B、C、D、E五种短周期元素的某些性质