
| A. | 碱金属单质的熔点随原子序数的增大而降低 | |
| B. | 金属元素的最外层电子数都小于4 | |
| C. | 已知硒(Se)位于第四周期第ⅥA族,其最高价氧化物对应水化物的化学式为H2SeO3 | |
| D. | 第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性 |
分析 A.碱金属属于金属晶体,半径越大,金属键越弱;
B.金属元素的最外层电子数大多数小于4,但部分元素的最外层电子数大于或等于4;
C、由S的最高价氧化物的水化物为硫酸可知,硒的最高价氧化物对应的水化物的化学式为H2SeO4;
D.N元素位于第二周期,氢化物为氨气,溶于水后溶液显碱性.
解答 解:A.因碱金属属于金属晶体,半径越大,金属键越弱,熔沸点越低,则碱金属单质的熔点随原子序数的增大而降低,故A正确;
B.金属元素的最外层电子数大多数小于4,但部分元素的最外层电子数大于或等于4,如铋、钋等,故B错误;
C、由S的最高价氧化物的水化物为硫酸可知,硒的最高价氧化物对应的水化物的化学式为H2SeO4,故C错误;
D.N元素位于第二周期,氢化物为氨气,溶于水后溶液显碱性,C的氢化物不溶于水,其余第二周期非金属元素(不包括Ne)的氢化物溶于水显酸性,故D错误;
故选A.
点评 本题考查元素周期表和元素周期律,熟悉元素的位置及同周期、同主族元素性质的变化规律即可解答,难度不大.


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:选择题
| A. | 已知酸性H2SO3>HClO>HSO3-,则向Na2SO3溶液中加入HClO的离子方程式为:SO32-+HClO=HSO3-+ClO- | |
| B. | PH=3的HClO溶液,加水稀释后,溶液中所有的离子浓度降低 | |
| C. | 在25°C时,次氯酸的电离方程式及热效应可表示为:HClO(aq)?H+(aq)+ClO-(aq);△H=-(57.3+Q1)kJ•mol-1 | |
| D. | 将20ml 1mol/L HClO溶液与10ml 1mol/L NaOH溶液混合后,所得的混合溶液中一定存在:2c(H+)-2c(OH-)=c(ClO-)-c(HClO) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
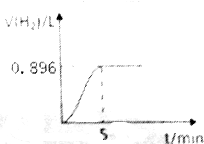 取1.27g钠铝合金放入50mL水中,充分反应后有固体剩余,其产生气体的体积随时间的变化曲线如图所示(气体体积已折算成标准状况),按要求回答下列问题:
取1.27g钠铝合金放入50mL水中,充分反应后有固体剩余,其产生气体的体积随时间的变化曲线如图所示(气体体积已折算成标准状况),按要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氮气的转化率减小 | |
| B. | 氢气的转化率增大 | |
| C. | 氨气在平衡混合气体中的百分含量一定增大 | |
| D. | 氨气的分解速率大于氨气的生成速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q2>Q1>57.3 | B. | Q1=57.3<Q2 | C. | Q2>57.3>Q1 | D. | Q2=57.3>Q1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以A表示的平均反应速率为0.1 mol•L-1•s-1 | |
| B. | 平衡时,B的浓度为1 mol•L-1 | |
| C. | n值等于1 | |
| D. | 平衡时B的转化率为50% |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
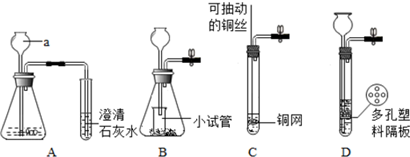
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子键是阴、阳离子间存在的静电引力 | |
| B. | 只有金属和非金属化合时才能形成离子键 | |
| C. | 含有离子键的化合物一定是离子化合物 | |
| D. | 第ⅠA族和第ⅦA族元素原子化合时,一定形成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
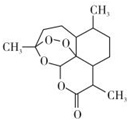 北京时问2015年10月5日,中国女科学家屠哟哟获颁诺贝尔医学奖.屠哟哟从中医古籍里得到启发,用乙醚从青蒿中提取出可以高效抑制疟原虫的成分-青蒿素(结构简式如图),这一发现在全球范围内挽救了数以百万人的生命.下列说法中不正确的是( )
北京时问2015年10月5日,中国女科学家屠哟哟获颁诺贝尔医学奖.屠哟哟从中医古籍里得到启发,用乙醚从青蒿中提取出可以高效抑制疟原虫的成分-青蒿素(结构简式如图),这一发现在全球范围内挽救了数以百万人的生命.下列说法中不正确的是( )| A. | 青蒿素的分子式为C15H22O5 | |
| B. | 青蒿素能发生取代反应 | |
| C. | 青蒿素属于芳香族化合物 | |
| D. | 用乙醚从青蒿中提取青蒿素,用到了萃取的原理 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com