
| A. | 用排饱和NaHCO3溶液的方法收集CO2 | |
| B. | 在H2O2溶液中加入MnO2加快生成O2的速率 | |
| C. | 工业制氨气时,使氨液化从混合气体中分离出来 | |
| D. | 加压条件下有利于SO2和O2反应生成SO3 |
分析 勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动,使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用.
解答 解:A.二氧化碳和水反应生成碳酸,碳酸电离生成碳酸氢根离子,碳酸氢钠电离生成的碳酸氢根离子抑制二氧化碳和水反应,所以可以用平衡移动原理解释,故A不选;
B.二氧化锰是双氧水分解的催化剂,只影响化学反应速率,不影响平衡移动,不能用平衡移动原理解释,故B选;
C.降低生成物浓度,平衡正向移动,所以工业制氨气时,使氨液化从混合气体中分离出来,降低氨气浓度,平衡正向移动,可以用平衡移动原理解释,故C不选;
D.SO2和O2反应生成SO3的反应是气体体积减小的可逆反应,增大压强,平衡向气体体积减小的方向移动,则增大压强平衡向生成三氧化硫的方向移动,可以用平衡移动原理解释,故D不选;
故选B.
点评 本题考查化学平衡移动原理,为高频考点,侧重考查学生分析判断能力,明确化学平衡移动原理适用范围是解本题关键,注意:只有引起平衡移动的条件才能用平衡移动原理解释,题目难度不大.


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
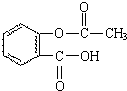 化学和环境保护、食品营养、材料应用等密切相关.
化学和环境保护、食品营养、材料应用等密切相关. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某实验小组设计了如图所示的甲醇燃料电池装置.
某实验小组设计了如图所示的甲醇燃料电池装置.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 福尔马林(蚁酸):加入足量饱和碳酸钠溶液充分振荡,蒸馏,收集馏出物 | |
| B. | 溴乙烷(乙醇):多次加水振荡,分液,弃水层 | |
| C. | 苯(苯酚):加溴水,振荡,过滤除去沉淀 | |
| D. | 溴苯(溴):加稀氢氧化钠溶液充分振荡洗涤后分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②③④ | C. | ②④⑤ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
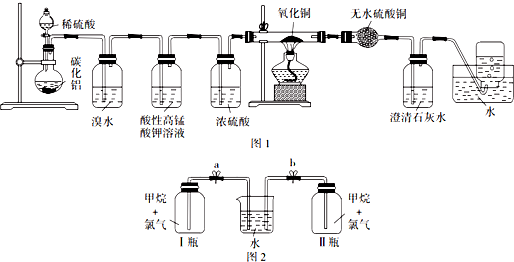
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
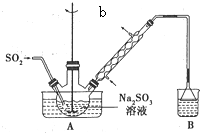 次硫酸氢钠甲醛(aNaHSO2•bHCHO•cH2O)俗称吊白块,有较强的还原性.它常温下比较稳定,在120℃以上分解成亚硝酸盐.以Na2SO3、SO2、HCHO和锌粉为原料可制备次硫酸氢钠甲醛.实验步骤如下:
次硫酸氢钠甲醛(aNaHSO2•bHCHO•cH2O)俗称吊白块,有较强的还原性.它常温下比较稳定,在120℃以上分解成亚硝酸盐.以Na2SO3、SO2、HCHO和锌粉为原料可制备次硫酸氢钠甲醛.实验步骤如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com