
| A. | ①②③④⑤ | B. | ②③④⑤① | C. | ③①④②⑤ | D. | ①③④②⑤ |
科目:高中化学 来源: 题型:选择题
| A. | υ(H2)=0.1 mol•L-1•min-1 | B. | υ(N2)=0.2 mol•L-1•min-1 | ||
| C. | υ(NH3)=0.15 mol•L-1•min-1 | D. | υ(H2)=0.3 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
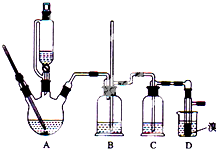 实验室用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示(加热及夹持装置省略):
实验室用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示(加热及夹持装置省略):| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
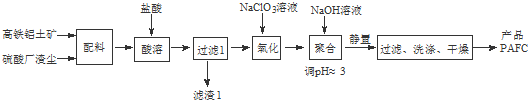
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
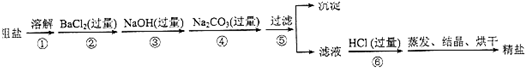
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
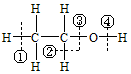 在化学反应中断键位置说法错误的是( )
在化学反应中断键位置说法错误的是( )| A. | 乙醇与钠反应,在④位置断裂,对比钠与水反应,乙醇比水更难电离出氢离子 | |
| B. | 乙醇与浓硫酸在170℃时,在②③位置断裂,以水分子的形式消去,属于消去反应 | |
| C. | 乙醇与浓硫酸在140℃时,在③或④位置断裂,该反应是取代反应 | |
| D. | 乙醇在铜催化下与氧气反应,在②④位置断裂,所以只有与羟基直接相连的碳原子上有氢原子才能发生催化氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由同种分子构成的物质一定是纯净物 | |
| B. | 纯净物一定由分子构成 | |
| C. | 混合物肯定是由两种以上的元素组成的 | |
| D. | 含有氧元素的化合物就是氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol H2SO4的质量是98 g/mol | |
| B. | CO2的摩尔质量等于CO2的相对分子质量 | |
| C. | 摩尔质量建立了物质的物质的量与物质的质量之间的联系 | |
| D. | 1 mol任何物质的质量等于该物质的相对分子质量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com