
| A. | 35Cl与37Cl与得电子能力相同 | |
| B. | 核外电子排布相同的微粒化学性质也相同 | |
| C. | 凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布 | |
| D. | 同主族元素含氧酸的酸性随核电荷数的增加而减弱 |
分析 A、最外层电子数相同所以得电子能力相同;
B、核外电子排布相同的微粒,化学性质不一定相同,如Ar原子与S2-离子;
C、单原子形成的离子不一定具有稀有气体原子的核外电子排布;
D、同主族元素最高价含氧酸自上而下酸性减弱;
解答 解:A、35Cl与37Cl质子数相同,所以最外层电子数相同,得电子能力相同,故A正确;
B、核外电子排布相同的微粒,化学性质不一定相同,如Ar原子化学性质稳定,而S2-离子具有强还原性,故B错误;
C、单原子形成的离子不一定具有稀有气体原子的核外电子排布,如H+,故C错误;
D、同主族元素最高价含氧酸自上而下酸性减弱,不是最高价含氧酸不一定,如HClO为弱酸、HBrO4为强酸,故D错误;
故选A.
点评 本题考查元素周期表的结构及应用,为高频考点,把握元素周期律、周期表中的族序数、原子序数等关系为解答的关键,题目难度不大.


 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:填空题
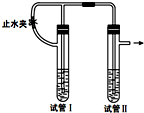 在如图装置中,用NaOH溶液、铁屑、稀硫酸等试剂制备Fe(OH)2.
在如图装置中,用NaOH溶液、铁屑、稀硫酸等试剂制备Fe(OH)2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(NaOH)=0时,c(H+)=1×10-2 mol/L | |
| B. | V(NaOH)=10mL时,c(H+)=1×10-7 mol/L | |
| C. | V(NaOH)<10mL时,可能存在c(Na+)=2c(C2O42-)+c(HC2O4-) | |
| D. | V(NaOH)>10mL时,c(C2O42-)>c(Na+)>c(HC2O4-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氡气在标准状况下密度约是19.8g•L-1 | |
| B. | 氡气化学性质较活泼,因此对人体有害 | |
| C. | “锕射气”是氡的同位素 | |
| D. | 氡原子核外有7个电子层,最外层有8个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 | 实验结论 | |
| 步骤① | 取适量NaOH固体放入烧杯中,加入适量的水,搅拌,插入一支温度计 测量溶液温度, | 溶液温度比室 温明显升高 | 氢氧化钠 固体溶于 水放热 |
| 步骤② | 步骤①所得的溶 液冷却到室温,用胶头滴管将稀盐酸滴入到步骤①所得的溶液中 | 溶液温度比室 温明显升高 | 氢氧化钠与稀盐 酸反应会放出热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用新制Cu(OH)2悬浊液检验乙醛:向10ml10%的硫酸铜溶液中加的2%NaOH溶液4-6滴,振荡后加入乙醛溶液0.5ml,加热 | |
| B. | 探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2mL5%H2O2和1mLH2O,向另一支试管中加入2mL5%H2O2和1mLFeCl3溶液,观察并比较实验现象 | |
| C. | 向盛有过量苯酚浓溶液的试管里逐滴加入稀溴水,边加边振荡,观察三溴苯酚的生成 | |
| D. | 提纯含有少量乙酸的乙酸乙酯:向含有少量乙酸的乙酸乙酯中加入过量饱和氢氧化钠溶液,振荡后静置分液,并除去有机层的水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
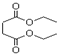
| A. | 1mol琥珀酸二乙酯能与4mol的NaOH反应 | |
| B. | 琥珀酸二乙酯在一定条件下能发生取代、加成和氧化反应 | |
| C. | 琥珀酸的分子式为C4H8O4 | |
| D. | 琥珀酸分子中含有六元环 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com