
 CO(g)+H2(g);△H=-Q。达到平衡后,改变温度使平衡发生移动,气体的平均相对分子质量如何变化?
CO(g)+H2(g);△H=-Q。达到平衡后,改变温度使平衡发生移动,气体的平均相对分子质量如何变化? =(m/n)
=(m/n) =(m+12x)/(n+x)?
=(m+12x)/(n+x)? =(m-12x)/(n-x)
=(m-12x)/(n-x) 减小;
减小; 不变;
不变; 增大。
增大。 增大;
增大; 不变;
不变; 减小。
减小。

科目:高中化学 来源:不详 题型:填空题
 Cl-+3 H+ +3 SO42-
Cl-+3 H+ +3 SO42-
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.体积减半,压强为原来的2倍 |
| B.体积减半,压强比原来大2倍。 |
| C.体积减半,压强增大,但小于原来的2倍。 |
| D.体积减半,达到平衡后,则有一半NO2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
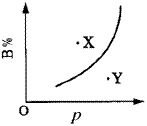
 qC(g)(正反应为吸热反应)的可逆反应中,在恒温条件下,B的体积分数(B%)与压强(p)的关系如图所示,有关叙述正确的是( )。
qC(g)(正反应为吸热反应)的可逆反应中,在恒温条件下,B的体积分数(B%)与压强(p)的关系如图所示,有关叙述正确的是( )。| A.n<q |
| B.n>q |
| C.X点,v正>v逆;Y点,v正<v逆 |
| D.X点比Y点反应速率快 |
 |
| |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 2NH3(正反应放热),若反应达到平衡后,测得混合气体为7体积。据此完成下列问题:
2NH3(正反应放热),若反应达到平衡后,测得混合气体为7体积。据此完成下列问题:
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 xC(g);ΔH<0符合图象(Ⅰ)所示关系。由此推断对图象(Ⅱ)的不正确说法是(p3>p4)( )
xC(g);ΔH<0符合图象(Ⅰ)所示关系。由此推断对图象(Ⅱ)的不正确说法是(p3>p4)( )
| A.Y轴表示A的转化率 | B.Y轴表示B的质量分数 |
| C.Y轴表示混合气体的密度 | D.Y轴表示混合气体的平均相对分子质量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 5Ca2++3
5Ca2++3 +OH-
+OH-查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 反应时间t(h) | 1 | 4 | 9 | 16 | 25 |
| MgO膜厚Y(nm) | 0.02a | 0.08a | 0.18a | 0.32a | 0.50a |
| ZnO膜厚Y(nm) | 1.0×10-3b | 4.0×10-3b | 9.0×10-3b | 1.6×10-2b | 2.5×10-2b |
| NiO膜厚Y(nm) | 0.3c | 0.6c | 0.9c | 1.2c | 1.5c |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com