
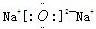
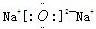
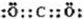
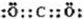
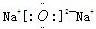 ,XY2为CO2,为共价化合物,电子式为
,XY2为CO2,为共价化合物,电子式为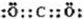 ,
,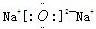 ;
;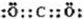 ;
;

 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源: 题型:
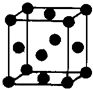 (2012?武汉模拟)[化学一选修 3:物质结构与性质]有U、V、W、X、Y、Z 六种前四周期元素,原子序数依次增大,其相关信息如下表:
(2012?武汉模拟)[化学一选修 3:物质结构与性质]有U、V、W、X、Y、Z 六种前四周期元素,原子序数依次增大,其相关信息如下表:| 元素编号 | 相关信息比 |
| U | 所处的周期数、族序数分别与其原子序数相等 |
| V | 基态时,电子分布在三个能级上,且各能级中电子数相等 |
| W | 基态时,2p 轨道处于半充满状态 |
| X | 与W元素处于同一周期,且X的第一电离能小于W的第一电离 |
| Y | 是第四周期元素中未成对电子数最多的元素 |
| Z | Z 的一种核素的质量数为65,中子数为 36 |
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W、Q、R均为前四周期元素,且原子序数依次增大。X元素的原子的半径在所有原子半径中最小,Y元素的基态原子中电子分布在三个不同的能级中,且每个能级中的电子总数相同,Z元素的气态氢化物与其最高价氧化物对应的水化物能发生化合反应,W元素的族序数是其周期数的三倍,Q为前四周期中电负性最小的元素,R元素的原子核外共有11个轨道中有成对电子。
请回答下列问题:(用具体的化学用语回答)
(1)Y元素的基态原子的电子排布式为 ,Z与W元素原子第一电离能较大的是 ,R元素在周期表中属于 区。
(2)XYZ的电子式为 ,其中Y原子的杂化方式是 ,ZW3-的空间构型为 。
(3)X、Y 、W、Q四种元素中任意三种元素可形成两种化合物甲和乙,且两种水溶液均呈碱性,甲能促进水的电离,乙能抑制水的电离,则甲的水溶液中离子浓度由大到小的顺序为 ;室温下,若甲和乙的水溶液的pH都为11,则两溶液中水电离的c(OH-)之比为(甲:乙) 。
(4)ZX3与氧气在NaOH溶液条件下可构成高能燃料电池,生成的产物对环境无污染,该电池的负极反应为 。
(5)RW42-具有强氧化性,在稀硫酸溶液中剧烈反应,得到一种无色气体和黄色溶液,该反应的离子方程式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com