
一定体积的KMnO4溶液恰好能氧化一定质量的KHC2O4·H2C2O4·2H2O。若用0.100 0 mol·L-1的NaOH溶液中和相同质量的KHC2O4·H2C2O4·2H2O,所需NaOH溶液的体积恰好为KMnO4溶液的3倍,则KMnO4溶液的浓度(mol·L-1)为
A.0.008 889 B.0.080 0 C.0.120 0 D.0.240 0
B
【解析】
试题分析:根据10[KHC2O4?H2C2O4]+8KMnO4+17H2SO4═8MnSO4+9K2SO4+40CO2↑+32H2O,得关系式:10[KHC2O4?H2C2O4]~8KMnO4
10 mol 8 mol
氢氧化钠与KHC2O4?H2C2O4?2H2O的反应方程式为:KHC2O4?H2C2O4?2H2O+6NaOH=K2C2O4+3Na2C2O4+6H2O,
可得3NaOH~KHC2O4?H2C2O4?2H2O
3 mol1 mol
故有10[KHC2O4?H2C2O4]~8KMnO4~30NaOH
8 30
设KMnO4溶液的浓度为x,高锰酸钾的体积为V
则有8:30=V?x:3V×0.1mol?L?1,解得x=0.08000mol?L?1,故B项正确。
考点:本题考查根据化学方程式和氧化还原反应的计算。


科目:高中化学 来源:2015届吉林省吉林市高三第一次摸底考试化学试卷(解析版) 题型:选择题
下列反应的离子方程式,书写正确的是
A.将氯气通入水中:Cl2+H2O=2H++Cl—+ClO—
B.在铁粉中加入硫酸铁溶液:Fe3++Fe=2Fe2+
C.氧化铜溶于稀硝酸:CuO+2H+=Cu2++H2O
D.小苏打与氢氧化钠两种溶液混合:HCO3—+OH—=CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源:2015届北京理工附中高三第一次月考化学试卷(解析版) 题型:填空题
(10分)X,Y,Z为三个不同短周期非金属元素的单质。在一定条件下有如下反应:Y+X→A(g),Y+Z→B(g)。请针对以下两种不同情况回答:
(1)若常温下X,Y,Z均为气体,A的相对分子质量大于B,且A和B化合生成固体C时有白烟产生,则:①C的电子式是__________;②B溶于水的过程中存在的可逆反应式为___________________________。
(2)若常温下Y为固体,X,Z为气体,A在空气中充分燃烧可生成B,则:①A的化学式是_________;②向苛性钠溶液中通入过量的B,所发生反应的离子方程式是_______________________。③若A的燃烧热为M kJ·mol-1,试写出该反应的热化学方程式_____________________
查看答案和解析>>
科目:高中化学 来源:2015届北京理工附中高三第一次月考化学试卷(解析版) 题型:选择题
下列四个数据是在不同条件下测出的合成氨反应的速率,其中最快的是
A.V(H2)==0.1mol/(L·min)
B.V(N2)==0.1mol/(L·min)
C.V(NH3)==0.15mol/(L·min)
D.V(N2)==0.002mol/(L·s)
查看答案和解析>>
科目:高中化学 来源:2015届北京市高三上学期第一次月考化学试卷(解析版) 题型:实验题
甲同学进行Fe2+还原性的实验,针对异常现象进行探究。
步骤一:制取FeCl2溶液。向0.1 mol?L-1 FeCl3溶液中加足量铁粉振荡,静置后取上层清液,测得pH<1。
步骤二:向2 mL FeCl2溶液中滴加2滴0.1 mol?L-1 KSCN溶液,无现象;再滴加5滴5% H2O2溶液(物质的量浓度约为1.5 mol?L-1、pH约为5),观察到溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2)。
(1)用离子方程式表示步骤二中溶液变红的原因: 、 。
(2)甲探究步骤二中溶液褪色的原因:
I.取褪色后溶液两份,一份滴加FeCl3溶液无现象;另一份滴加KSCN溶液出现红色;
II.取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀。
III.向2 mL 0.1 mol?L-1 FeCl3溶液中滴加2滴0.1 mol?L-1 KSCN溶液,变红,通入O2,无明显变化。
实验I的说明 ;
实验III的目的是 。
得出结论:溶液退色的原因是酸性条件下H2O2将SCN-氧化成SO42-。
(3)甲直接用FeCl2·4H2O配制 mol?L-1 的FeCl2溶液,重复步骤二中的操作,发现液体红色并未褪去。进一步探究其原因:
I.用激光笔分别照射红色液体和滴加了KSCN溶液的FeCl3溶液,前者有丁达尔效应,后者无。测所配FeCl2溶液的pH约为3。由此,乙认为红色不褪去的可能原因是 。
II.查阅资料后推测,红色不褪去的原因还可能是pH较大时H2O2不能氧化SCN-。乙利用上述部分试剂,通过实验排除了这一可能。乙的实验操作及现象是:
步骤 | 试剂及操作 | 现 象 |
i |
| 生成白色沉淀 |
ii | 向i所得溶液中滴加0.1 mol?L-1 FeCl3溶液 |
|
查看答案和解析>>
科目:高中化学 来源:2015届北京市高三上学期第一次月考化学试卷(解析版) 题型:选择题
在常温下,发生下列几种反应:①16H++10Z-+2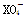 ===2X2++5Z2+8H2O
===2X2++5Z2+8H2O
②2A2++B2===2A3++2B-
③2B-+Z2===B2+2Z-
根据上述反应,下列结论判断错误的是
A.溶液中可发生:Z2+2A2+===2A3++2Z-
B.Z2在①③反应中为氧化剂
C.氧化性强弱的顺序为: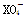 >Z2>B2>A3+
>Z2>B2>A3+
D.X2+是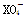 的还原产物
的还原产物
查看答案和解析>>
科目:高中化学 来源:2015届北京市高三上学期第一次月考化学试卷(解析版) 题型:选择题
已知四种盐的溶解度(S)曲线如右图所示,下列说法不正确的是

A.将NaCl溶液蒸干可得NaCl固体
B.将MgCl2溶液蒸干可得MgCl2固体
C.可用MgCl2和NaClO3制备Mg(ClO3)2
D.Mg(ClO3)2中混有少量NaCl杂质,可用重结晶法提纯
查看答案和解析>>
科目:高中化学 来源:2015届北京市高三上学期第一次质量检测化学试卷(解析版) 题型:选择题
下列关于实验现象的描述不正确的是
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.用锌片做阳极,铁片做阴极,电解氯化锌溶液,铁片表面出现一层锌
C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
查看答案和解析>>
科目:高中化学 来源:2015届北京市朝阳区高三年级第一学期期中统一考试化学试卷(解析版) 题型:选择题
下列说法正确的是
①通过丁达尔效应可以鉴别稀豆浆和Fe(OH)3胶体
②常温时,FeCl3溶液中Fe3+与Cl-的个数之比等于1:3
③化学方程式Br2 + 2KI = 2KBr + I2说明Br的非金属性强于I
④常温时,0.1 mol·L-1 盐酸中由水电离出的c(H+)<10-7mol·L-1
A.①② B.③④ C.①③ D.②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com