
【题目】乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物. 
完成下列各题:
(1)正四面体烷的分子式为 , 其二氯取代产物有种.
(2)关于乙烯基乙炔分子的说法错误的是:; a.能使酸性KMnO4溶液褪色
b.1mol乙烯基乙炔能与3mol Br2发生加成反应
c.乙烯基乙炔分子内含有两种官能团
d.等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量不相同
(3)写出与环辛四烯互为同分异构体且属于芳香烃的分子的结构简式 .
(4)写出与苯互为同系物且一氯代物只有两种的物质的结构简式(举两例):、 .
【答案】
(1)C4H4;1
(2)D
(3)![]()
(4)![]() ;
;
【解析】解:(1)根据正四面体烷的每个顶点代表一个碳原子,碳可形成4对共用电子对,每个碳原子上都连有一个氢原子,正四面体烷的分子式为C4H4;分子为正四面体对称结构,分子中只有1种H原子、每个C原子上只有1个H原子,二氯代产物只有1种; 所以答案是:C4H4;1种;(2)a、因乙烯基乙炔为CH2=CH﹣C≡CH,乙烯基乙炔分子中含有一个碳碳双键、一个碳碳三键,而碳碳双键、碳碳三键都能使酸性KMnO4溶液褪色,故a错误;
b、因1mol乙烯基乙炔分子中1mol碳碳双键、1mol碳碳三键,1mol碳碳双键能和1摩尔Br2发生加成反应,1mol碳碳三键能和2摩尔Br2发生加成反应,所以1摩尔乙烯基乙炔能与3摩尔Br2发生加成反应,故b错误;
c、乙烯基乙炔分子中含有的官能团有:碳碳双键、碳碳三键,故c错误;
d、因等质量的烃(CXHY)完全燃烧时耗氧量取决于 ![]() ,而乙烯基乙炔为CH2=CH﹣C≡CH最简式为CH,乙炔C2H2的最简式为CH,二者最简式相同,二者质量相同,消耗氧气相同,故d正确;故选:d;(3)环辛四烯的分子式为C8H8 , 不饱和度为5,属于芳香烃的同分异构体,含有1个苯环,侧链不饱和度为1,故含有1个侧链为﹣CH=CH2 , 属于芳香烃的同分异构体的结构简式
,而乙烯基乙炔为CH2=CH﹣C≡CH最简式为CH,乙炔C2H2的最简式为CH,二者最简式相同,二者质量相同,消耗氧气相同,故d正确;故选:d;(3)环辛四烯的分子式为C8H8 , 不饱和度为5,属于芳香烃的同分异构体,含有1个苯环,侧链不饱和度为1,故含有1个侧链为﹣CH=CH2 , 属于芳香烃的同分异构体的结构简式 ![]() ,
,
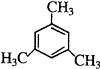
所以答案是: ![]() ;(4)与苯互为同系物,侧链为烷基,一氯代物只有两种,说明该有机物中只有2种H原子,与苯互为同系物且一氯代物有两种物质,必须考虑对称结构,考虑最简单的取代基﹣CH3情况,符合条件的物质的结构简式为
;(4)与苯互为同系物,侧链为烷基,一氯代物只有两种,说明该有机物中只有2种H原子,与苯互为同系物且一氯代物有两种物质,必须考虑对称结构,考虑最简单的取代基﹣CH3情况,符合条件的物质的结构简式为 ![]() 或
或 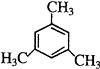 等,所以答案是:
等,所以答案是: ![]() ;
; 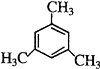 .
.


科目:高中化学 来源: 题型:
【题目】某有机物M的结构简式为CH3CH=CHCH2COOH,下列有关说法正确的是( )
A. 能与乙醇发生酯化反应
B. 不能使酸性高锰酸钾溶液褪色
C. 能与溴的四氯化碳溶液发生取代反应
D. 1 mol M与足量Na完全反应能生成1 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在水溶液中能大量共存的是( )
A.H+、Fe2+、NO3-、Cl-B.S-、Na+、H+、K+
C.K+、CO32-、Br-、AlO2-D.H+、Cl-、Na+、S2O32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铝镁[MgaAlb(OH)c(CO3)dxH2O]常用作塑料阻燃剂. 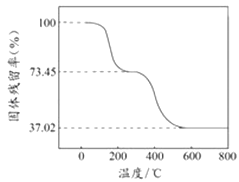
(1)碱式碳酸铝镁具有阻燃作用,是由于其受热分解需吸收大量热量和 .
(2)[MgaAlb(OH)c(CO3)dxH2O]中的a、b、c、d的代数关系式为 .
(3)为确定碱式碳酸铝镁的组成,进行如下实验:
①准确称取3.390g样品与足量稀盐酸充分反应,生成CO2 0.560L(已换算成标准状况下).
②另取一定量样品在空气中加热,样品的固体残留率( ![]() ×100%)随温度的变化如图所示(样品在270℃时已完全失去结晶水,600℃以上残留固体为金属氧化物的混合物).
×100%)随温度的变化如图所示(样品在270℃时已完全失去结晶水,600℃以上残留固体为金属氧化物的混合物).
根据以上实验数据计算碱式碳酸铝镁样品中的n(OH﹣):n(CO32﹣)(写出计算过程).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用以下三种途径来制取等质量的硝酸铜。
①铜与稀硝酸反应;②铜与浓硝酸反应;③铜先与氧气反应生成氧化铜,氧化铜再与硝酸反应。以下叙述不正确的是
A. 三种途径所消耗铜的质量相等
B. 三种途径所消耗硝酸的物质的量是①>②>③
C. 途径③的制备方法最符合“绿色化学“理念
D. 途径①中还原剂与氧化剂的物质的量之比是3: 8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH3﹣CH═CH2+HBr﹣→CH3﹣CHBr﹣CH3(主要产物).1mol某烃A充分燃烧后可以得到8mol CO2和4mol H2O.该烃A在不同条件下能发生如图所示的一系列变化. 
(1)A的化学式: , A的结构简式: .
(2)上述反应中,①是反应,⑦是反应.(填反应类型)
(3)写出C、D、E、H物质的结构简式: C , D , E , H .
(4)写出D﹣→F反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)稀硫酸跟氧化镁反应(写出离子方程式)
(2)盐酸跟碳酸氢钠溶液反应(写出离子方程式)
(3)Cu2++2OH﹣=Cu(OH)2↓(写出化学方程式)
(4)氢氧化铁胶体制备(写出化学方程式) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:归纳正确的是( ) ①向0.1molL﹣1 CH3COOH溶液中加入少量冰醋酸,平衡向正反应方向移动,电离程度增大;②常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,则有c(Na+)+c(H+)=c(OH﹣)+c(CH3COO﹣)
③常温下,AgCl在同物质的量浓度的CaCl2和NaCl溶液中的溶解度相同;④常温下,已知醋酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh;水的离子积为Kw;则有:KaKh=Kw .
A.①②④
B.②④
C.②③
D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对有关实验寧实的说明或解释正确的是
A. 用坩埚钳夹住一小块用砂纸打磨过的铝箔在洒精灯上加热,铝熔化但不滴落,说明Al2O3的熔点高于Al
B. 向某溶液中先淌加Ba(NO3)2溶液,出现白色沉淀,再滴加稀硝酸,沉淀不溶解,说明原溶液中一定含有SO42-
C. 向新制氯水中加入少量NaHCO3固体,出现较多气体,说明HClO的酸性强于H2CO3
D. 向某溶液中先滴加KSCN溶液,溶液不变红,再滴加双氧水,溶液变红,说明原溶液中一定含有Fe2+
【答案】AD
【解析】A、加热打磨过后的铝箔,铝表面生成氧化铝薄膜,铝熔化说明铝熔点低,但铝不滴落,说明氧化铝熔点非常高,故A正确;B、溶液中也可能存在的SO32-,Ba2+与SO32-反应生成白色的BaSO3沉淀,SO32-有强还原性,再加硝酸,硝酸将BaSO3氧化为不溶于硝酸的BaSO4,所以无法判断原溶液中是否含有SO42-,故B错误;C、氯气与水反应生成盐酸和次氯酸,加入NaHCO3固体,产生CO2,只能说明氯水酸性强于H2CO3,并不能说明HClO酸性强于碳酸,故C错误;D、向溶液中先滴加KSCN溶液,溶液不变红,则证明溶液中不含Fe3+,再加双氧水,溶液变红,说明原溶液中一定含有Fe2+被双氧水氧化为Fe3+,故D正确。故选AD。
【题型】多选题
【结束】
21
【题目】某种制取纯碱的方法如下:
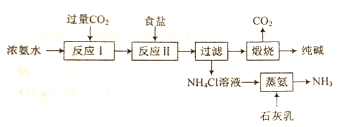
(1)写出“反应I ”的化学方程式:__。
(2)“反应Ⅱ”为复分解反应,反应中所涉及物质的溶解度如图所示。写出“反应Ⅱ”的化学方程式:__。

(3)写出“煅烧”反应的化学方程式:__。
(4) “蒸氨”时需要加热,写出“蒸氨”时反应的化学方程式:___。
(5)写出将“蒸氨”产生的氨气通入Al2(SO4)3溶液中时反应的离子方程式: __。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com