
| A. | 玻璃棒 | B. | 胶头滴管 | C. | 托盘天平 | D. | 容量瓶 |
科目:高中化学 来源: 题型:多选题
| A. | MgCl2 | B. | FeSO4 | C. | Na2SO3 | D. | ZnSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 0.01mol•L-1的溶液 | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
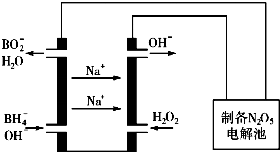
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 编号 | T(℃) | NO初始浓度 (mol•L-1) | CO初始浓度 (mol•L-1) | 催化剂的比表 面积(m2•g-1) |
| Ⅰ | 280 | 1.2×10-3 | 5.8×10-3 | 82 |
| Ⅱ | 1.2×10-3 | 124 | ||
| Ⅲ | 350 | 82 |
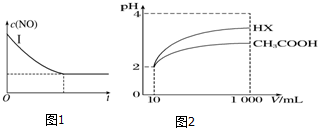
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平 衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 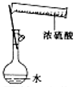 配制一定物质的量浓度的稀硫酸 | B. | 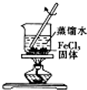 制取少量的Fe(OH)3胶体 | ||
| C. | 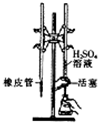 用H2SO4标准溶液滴定NaOH溶液 | D. | 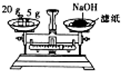 称量NaOH固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 铁的状态 | 盐酸的浓度 | 反应的温度 |
| A | 片状 | 1 mol/L | 20℃ |
| B | 片状 | 3 mol/L | 40℃ |
| C | 粉末 | 1 mol/L | 20℃ |
| D | 粉末 | 3 mol/L | 40℃ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 催化剂不参加化学反应 | B. | 醇和酸反应的产物未必是酯 | ||
| C. | 卤代烃的水解产物一定是醇 | D. | 醇脱水的反应都属于消去反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com