
【题目】一种熔融碳酸盐燃料电池原理示意如图.下列有关该电池的说法正确的是( ) 
A.电极B上发生的电极反应为:O2+2CO2+4e﹣=2CO32﹣
B.电极A上H2参与的电极反应为:H2+2OH﹣﹣2e﹣=2H2O
C.电池工作时,CO32﹣向电极B移动
D.反应CH4+H2O ![]() 3H2+CO,每消耗1molCH4转移12mol 电子
3H2+CO,每消耗1molCH4转移12mol 电子
科目:高中化学 来源: 题型:
【题目】化学与环境密切相关,下列说法错误的是( )
A. 酸雨是指pH<5.6的雨水
B. 二氧化碳大量排放会造成温室效应
C. 白色污染会造成“水华”和“赤潮”
D. 燃煤中掺入生石灰能有效减少SO2的排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于原子结构、元素性质的说法正确的是( )
A.非金属元素组成的化合物中只含共价键
B.ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强
C.同种元素的原子均有相同的质子数和中子数
D.IA族金属元素是同周期中金属性最强的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知(CH3COOH)2(g)2CH3COOH(g),经实验测得不同压强下,体系的平均摩尔质量随温度(T)的变化曲线如图所示,下列说法正确的是( ) 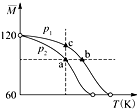
A.该过程的△H<0
B.气体压强:p(a)<p(b)=p(c)
C.平衡常数:K(a)=K(b)<K(c)
D.测定乙酸的相对分子质量要在高压、低温条件
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用CaSO4代替O2与燃料CO反应是一种高效、清洁的新型燃烧技术.反应如下:
① ![]() CaSO4(s)+CO(g)
CaSO4(s)+CO(g) ![]() CaS(s)+CO2(g)△H1=﹣47.3 kJmol﹣1
CaS(s)+CO2(g)△H1=﹣47.3 kJmol﹣1
②CaSO4(s)+CO(g)CaO(s)+CO2(g)+SO2(g)△H2=+210.5kJmol﹣1
③CO(g) ![]() C(s)+
C(s)+ ![]() CO2(g)△H3=﹣86.2kJmol﹣1 .
CO2(g)△H3=﹣86.2kJmol﹣1 .
下列说法错误的是( )
A.反应①达到平衡时,增大压强平衡不移动
B.反应②的平衡常数表达式为K= ![]()
C.反应①和②是主反应,反应③是副反应
D.2CaSO4(s)+7CO(g)?CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g)是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
(1)配制0.50mol/L NaOH溶液
(i)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体g.
(ii)从图中选择称量NaOH固体所需要的仪器是(填字母):
名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
仪器 |
|
|
|
|
|
|
序号 | a | b | c | d | e | f |
(2)测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示. 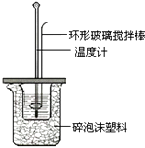
(i)写出该反应的热化学方程式(中和热为57.3kJ/mol): .
(ii)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表.
①请填写下表中的空白:
温度 | 起始温度t1/℃ | 终止温度 | 温度差平均值 | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4/p> | |
②近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3 , 中和后生成溶液的比热容c=4.18J/(g℃).则中和热△H=(取小数点后一位).
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母) .
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com