
对于mA(s)+nB(g)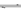 pC(g)的可逆反应,在一定温度下C的百分含量与压强的关系如图所示,则下列判断正确的是
pC(g)的可逆反应,在一定温度下C的百分含量与压强的关系如图所示,则下列判断正确的是
A.m+n<p B.n>p
C.x点的状态是v正>v逆 D.y点的状态是v正>v逆
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
有①H2NCH2COOH ②CH2OH(CHOH)4CHO
③(C6H10O5)n(纤维素) ④HCOOC2H5 ⑤苯酚 ⑥HCHO等物质,其中(用数字序号填空):
(1)难溶于水的是________,易溶于水的是________,常温下微溶于水的是________。
(2)能发生银镜反应的是________。
(3)能发生酯化反应的是________。
(4)能跟氢气发生加成反应的是________,能在一定条件下跟水反应的是________。
(5)能跟盐酸反应的是________,能跟氢氧化钠溶液反应的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是a、b两种不同物质的熔化曲线,下列说法中正确的是 ( )。
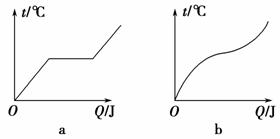
①a是晶体 ②a是非晶体 ③b是晶体 ④b是非晶体
A.①④ B.②④ C.①③ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
酒精、乙酸和葡萄糖三种溶液,只用一种试剂就能将它们区别开来,该试剂是( )
A.金属钠 B.石蕊试液
C.新制的氢氧化铜悬浊液 D.NaHCO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.增大反应物浓度,可增大活化分子的百分数,从而使有效碰撞次数增多
B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
C.升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数
D.催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
右图曲线a表示放热反应X(g) + Y(g)  Z(g) + M(g) + N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是
Z(g) + M(g) + N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是
A.升高温度 B.加大X的投入量
C.加催化剂 D.增大体积

查看答案和解析>>
科目:高中化学 来源: 题型:
把6molA和5molB两气体通入容积为4L的密闭容器中,一定条件下反应:
3A(g)+B(g)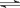 2C(g)+x D(g)△H > 0,5min达平衡,此时生成2molC,测得D的
2C(g)+x D(g)△H > 0,5min达平衡,此时生成2molC,测得D的
平均反应速率为0.1mol·(L·min)-1。下列说法中正确的是( )
A.降低平衡体系的温度,逆反应速率减小,正反应速率增大,平衡正向移动
B.恒温下达到平衡的标志是C和D的生成速率相等
C.A的平均反应速率为0.15mol·(L·min)-1
D.B的转化率为25%
查看答案和解析>>
科目:高中化学 来源: 题型:
苯甲酸广泛用于医药、食品、染料、化工等领域。以下是实验室制备苯甲酸的一种方法。反应原理如下:

 实验步骤:
实验步骤:
下图组装反应装置(冷凝水.夹持及加热装置未画出),并在三颈烧瓶中依次加入120mL水、9.4g高锰酸钾和3.0mL甲苯。
②将三颈烧瓶中的混合液体搅拌,加热至沸腾,直到甲苯完全反应。
③趁热过滤反应混合物。若滤液呈紫色,则需加入适量的亚硫酸氢钠溶液至紫色褪去后再过滤,用热水洗涤滤渣,洗涤液合并至滤液中。
④用冰水冷却滤液,然后用浓盐酸酸化,过滤,用少量冷水洗涤滤渣,得到苯甲酸粗产品,经重结晶得到精制的苯甲酸。
回答下列问题:
(1)本实验应选择的三颈烧瓶规格为 (填字母序号)。
A.100 mL B.250 mL C.500 mL D.1000 mL
(2)判断甲苯已完全反应的现象是 、回流液不再出现油珠。
(3)实验步骤④中,用少量冷水而不用热水洗涤滤渣的目的是 ;
苯甲酸粗产品除了可用重结晶法精制外,还可用 法。
A.蒸发 B.升华 C.过滤 D.分液
(4)精制的苯甲酸纯度测定:称取1.220g样品,用稀乙醇溶解并配成100 mL溶液,分别取25.00mL溶液,用0.1000 mo1·L-1NaOH标准溶液滴定,三次滴定消耗NaOH溶液的体积分别为V1=24.70mL、V2=24.80 mL、V3= 25.80mL。
①配制溶液时用稀乙醇而不 用蒸馏水作溶剂的原因是 。
用蒸馏水作溶剂的原因是 。
②若用酚酞作指示剂,确定滴定终点 的现象是 。
的现象是 。
③产品的纯度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某溶液中可能含有NH4+、SO32—、SO42-、NO3-及其它某些未知离子,某学生取适量试液放入试管中,然后进行如下实验并得出相应的结论,其中合理的是
A.加入BaCl2溶液得到白色,过滤并洗涤沉淀,然后将沉淀加入到足量的稀硝酸中,沉淀无任何变化,说明该溶液中一定含有SO42-
B.加入BaCl2溶液得到白色,过滤并洗涤沉淀,然后将沉淀加入到足量的稀盐酸中,沉淀溶解并产生刺激性气味的气体,说明该溶液中一定含有SO32-
C.加入1mL0.2mol/L的NaOH,将湿润的紫色石蕊试纸靠近试管口,试纸无变化,说明溶液中一定无NH4+
D.加入锌片后无变化,再加入适量的稀硫酸,锌片溶解并有气泡产生,该溶液中一定含有NO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com