
| A. | NH3、NH4+、NH-的电子数相等,化学性质也相同 | |
| B. | 一定温度下液氨中c(NH4+)•c(NH2-)是一个常数 | |
| C. | 液氨的电离达到平衡时c(NH3)≠c(NH4+)=c(NH2-) | |
| D. | 加入其他物质,c(NH4+)/c(NH2-)可能不变 |
分析 A.NH3、NH4+、NH-的电子数相等,但结构不同,化学性质不同;
B.液氨中 c (NH4+ )与 c (NH2- )的乘积只与温度有关;
C.液氨电离达到平衡状态时,c (NH4+ )=c (NH2- )小于c (NH3 );
D.只要不破坏氨分子的电离平衡,液氨中c (NH4+ )=c (NH2- ).
解答 解:A.NH3、NH4+、NH-的电子数相等,结构不同化学性质也不相同,故A错误;
B.液氨中 c (NH4+ )与 c (NH2- )的乘积只与温度有关,与溶液的浓度无关,所以只要温度一定,液氨中 c (NH4+ )与 c (NH2- )的乘积为定值,故B正确;
C.液氨的电离是微弱的,所以液氨电离达到平衡状态时,c (NH4+ )=c (NH2- )<c (NH3 ),故C正确;
D.只要不破坏氨分子的电离平衡,液氨电离出的NH4+ 和NH2- 的物质的量就相等,因为溶液的体积相等,所以c (NH4+ )=c (NH2- ),比值可能不变,故D正确;
故选A.
点评 本题考查了弱电解质的电离,依据水的电离平衡进行分析解答即可,注意液氨中 c (NH4+ )与 c (NH2- )的乘积只与温度有关,与溶液的浓度无关,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 1mol | B. | 2 mol | C. | 3mol | D. | 4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
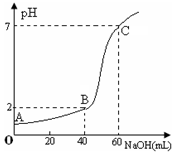 常温下,取20mL某浓度的盐酸作为待测液,用一定物质的量浓度的NaOH溶液进行滴定(假设盐酸与NaOH溶液混合后体积变化忽略不计),滴定过程中溶液的pH变化如右图所示.下列叙述不正确的是( )
常温下,取20mL某浓度的盐酸作为待测液,用一定物质的量浓度的NaOH溶液进行滴定(假设盐酸与NaOH溶液混合后体积变化忽略不计),滴定过程中溶液的pH变化如右图所示.下列叙述不正确的是( )| A. | 所用盐酸的浓度是0.09mol•L─1,NaOH溶液浓度为0.03mol•L─1 | |
| B. | 在B点,溶液中离子浓度关系为:c(Cl─)>c(Na+)>c(OH-)>c(H+) | |
| C. | A、B、C三点水的电离程度大小依次为:C>B>A | |
| D. | 滴定前,锥形瓶用待测液润洗,导致盐酸浓度偏低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PM2.5含有的铅、铬、镉、钒、砷等对人体有害的元素均是金属元素 | |
| B. | 绿色化学的核心是利用化学原理减少和消除工业生产对环境的污染 | |
| C. | 水泥冶金厂常用高压电除去工厂烟尘,利用了胶体的性质 | |
| D. | 二氧化硫的大量排放是造成光化学烟雾的主要原因 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+) | |
| B. | 两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则C1=l0C2 | |
| C. | pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 | |
| D. | NaHCO3溶液中有:HCO3-+H2O?CO32-+H3O+加水稀释后,H+浓度减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烧碱溶液与小苏打溶液反应:OH-+HCO3═H2O+CO2↑ | |
| B. | 氯水与烧碱溶液反应:2Al+2OH-+H2O═2AlO2-+2H2↑ | |
| C. | 氯化亚铁溶液中滴加氯水:2Fe2++Cl2═2Fe3++2Cl- | |
| D. | 氯气通入冷的氢氧化钠溶液中:2Cl2+2OH-═3Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数( 25℃) | Ka=1.8×10-5 | Ka=4.9×10-10 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
| A. | pH=a 的 CH3COOH 溶液,稀释 10 倍后,其 pH=b,则 a+1<b | |
| B. | pH=5 的 H2CO3 溶液中,c(H+)=c(HCO3-)=1×10-5 mol/L | |
| C. | pH相同的①CH3COONa ②NaHCO3 ③NaCN 三种溶液的 c(Na+):①>②>③ | |
| D. | 等浓度等体积的①CH3COONa 和②NaCN 溶液,溶液中阴离子数目:②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com