
【题目】下面有关晶体的叙述中不正确的是( )
A.金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子
B.氯化钠晶体中,每个Na+周围距离最近且相等的Na+共有6个
C.氯化铯晶体中,每个Cs+周围紧邻8个Cl-
D.干冰晶体中,每个CO2分子周围紧邻12个CO2分子
 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组欲测定 KClO3溶液与NaHSO3溶液反应的化学反应速率。所用试剂为10mL0.1mol/LKClO3溶液和10mL0.3mol/LNaHSO3溶液,所得数据如图所示。
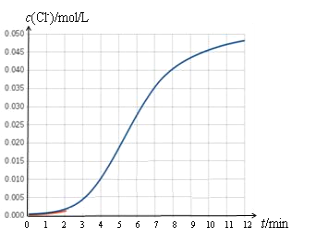
已知:ClO3 + 3HSO3=Cl + 3SO42 + 3H+
(1)根据实验数据可知,该反应在0~4min的平均反应速率:v(Cl-)=_________mol/(L·min)。
(2)某同学仔细分析实验数据后发现,在反应过程中,该反应的化学反应速率先增大后减小。某小组同学针对这一现象进一步通过测定 c(Cl-)随时间变化的曲线探究影响因素,具体如下表所示。
方案 | 假设 | 实验操作 |
I | 该反应放热,使溶液温度升高,反应速率加快 | 向烧杯中加入10mL0.1mol/LKClO3溶液和10mL0.3mol/LNaHSO3溶液, |
II | 取10mL0.1mol/LKClO3溶液加入烧杯中,向其中加入少量NaCl固体,再加入10mL0.3mol/LNaHSO3溶液。 | |
III | 溶液酸性增强加快了化学反应速率 | 分别向2只烧杯中加入10mL0.1mol/LKClO3溶液;向烧杯①中加入1 mL水,向烧杯②中加入1mL0.2mol/L 盐酸;再分别向2只烧杯中加入10mL0.3mol/LNaHSO3溶液。 |
①补全方案I中的实验操作:_____。
②方案II中的假设为_____。
③除I、II、III中的假设外,还可以提出的假设是_____。
④在已知方案 I 的假设不成立的情况下,某同学从控制变量的角度思考,认为方案III中实验操作设计不严谨,请进行改进:_____。
⑤反应后期,化学反应速率变慢的原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4Na2SO42H2O2NaCl又称固体双氧水,具有漂白、杀菌、消毒作用,又由于其稳定性比过碳酸钠(2Na2CO33H2O2)固体更好,因而具有广泛的应用前景。某小组合成该固体双氧水的实验步骤和装置示意图如下:
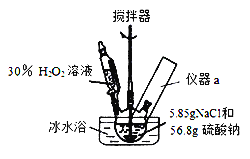
Ⅰ.合成:往三颈瓶中加入56.8g硫酸钠和5.85gNaCl的固体混合物,开启搅拌器;将稍过量的(约70mL)30%H2O2溶液在20~30min内逐滴分批加入。并控制反应温度15~35℃,加完料后持续搅拌15min,反应结束后过滤,低温干燥得到产品。
Ⅱ.产品稳定性取Ⅰ中所得产品置于干燥器内保存一个月,并分别在放置前、放置后取一定质量的样品溶于水,加适量稀硫酸酸化,用0.1000mol/L酸性高锰酸钾滴定,测定产品中双氧水的含量,以此分析产品的稳定性.所得实验数据如下表:
数据 时间 | 样品取用数量(g) | 平均V(KMnO4)/mL |
放置前测定 | a | 25.00 |
放置一个月后测定 | a | 24.90 |
已知:a.H2O2不稳定,加热,加入某些金属离子或加碱均有利于其分解
b.产品稳定性=![]() ×100%
×100%
请回答下列问题:
(1)装置图里方框中应添加仪器a,其名称为_______________________;写出合成4Na2SO42H2O2NaCl的化学方程式:_____________________________。
(2)该合成反应过程中,关键是控制温度,其合理的措施是:______________。
A.逐滴滴加H2O2 B.选用Na2SO4和NaCl固体,而不用其饱和溶液
C.不断搅拌 D.冰水浴
(3)该合成反应过程中30%的H2O2溶液不应大大过量的原因________________。
(4)4Na2SO42H2O2NaCl固体比过碳酸钠(2Na2CO33H2O2)固体更稳定的可能原因是__________。
(5)产品分析实验时,高锰酸钾溶液装于滴定管中,当滴定到达终点时的现象是_________________。下列关于该滴定实验过程中的仪器选择和操作都正确的是_____________
A.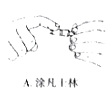 B.
B.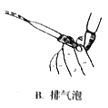 C.
C. D.
D.
(6)该产品的“产品稳定性”=___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中采用废旧易拉罐(主要成分为Al,含少量Fe、Mg杂质)制备明矾[KAl(SO4)2·12H2O的过程如图所示:
![]()
下列说法不正确的是
A.试剂①可以选用NaOH溶液
B.NH4HCO3用于调节滤液A的pH
C.操作a是蒸发浓缩、冷却结晶、过滤
D.明矾溶液显酸性,常作消毒杀菌剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素A、B、C都是短周期元素,A元素原子的2p轨道上只有两个未成对电子,B的3p轨道上有空轨道,A、B同主族,B、C同周期,C是本周期中电负性最大的。请回答:
(1)A原子的核外电子排布的轨道表示式________,B原子的核外电子排布式______________________,C原子的价电子排布式________。
(2)A、B、C的气态氢化物的化学式分别是________,其中最不稳定的是________。
(3)它们的最高价氧化物的水化物中,酸性最强的是________。
(4)AC4的化学式________,电子式________,结构式________,中心原子A的杂化方式________杂化,是________(填“极性”或“非极性”)分子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图中的实验方案,能达到实验目的是( )
A.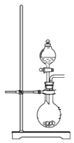 可用于制取少量NH3或用MnO2和浓盐酸制取Cl2
可用于制取少量NH3或用MnO2和浓盐酸制取Cl2
B.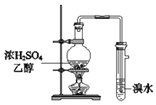 可用于制取乙烯并检验乙烯
可用于制取乙烯并检验乙烯
C.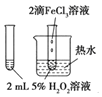 可以验证FeCl3对H2O2分解反应有催化作用
可以验证FeCl3对H2O2分解反应有催化作用
D.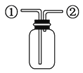 先从
先从![]() 口进气集满CO2,再从
口进气集满CO2,再从![]() 口进气,可用于收集NO
口进气,可用于收集NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学利用原电池装置探究物质的性质。资料显示:原电池装置中,负极反应物的还原性越强,或正极反应物的氧化性越强,原电池的电压越大。
(1)同学们利用下表中装置进行实验并记录。
装置 | 编号 | 电极A | 溶液B | 操作及现象 |
| Ⅰ | Fe | pH=2的H2SO4 | 连接装置后,石墨表面产生无色气泡;电压表指针偏转 |
Ⅱ | Cu | pH=2的H2SO4 | 连接装置后,石墨表面无明显现象;电压表指针偏转,记录读数为a |
①同学们认为实验Ⅰ中铁主要发生了析氢腐蚀,其正极反应式是_____________。
②针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其判断依据是_______;乙同学认为实验Ⅱ中应发生吸氧腐蚀,其正极的电极反应式是___________。
(2)同学们仍用上述装置并用Cu和石墨为电极继续实验,探究实验Ⅱ指针偏转原因及影响O2氧化性因素。
编号 | 溶液B | 操作及现象 |
Ⅲ | 经煮沸的pH=2的 H2SO4 | 溶液表面用煤油覆盖,连接装置后,电压表指针微微偏转,记录读数为b |
Ⅳ | pH=2的H2SO4 | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为c;取出电极,向溶液中加入数滴浓Na2SO4溶液混合后,插入电极,保持O2通入,电压表读数仍为c |
Ⅴ | pH=12的NaOH | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为d |
①丙同学比较实验Ⅱ、Ⅲ、Ⅳ的电压表读数为:c>a>b,请解释原因是_____________。
②丁同学对Ⅳ、Ⅴ进行比较,其目的是探究_____________________对O2氧化性的影响;实验Ⅳ中加入Na2SO4溶液的目的是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示某可逆反应在使用和未使用催化剂时,反应过程和能量的对应关系。下列说法一定正确的是
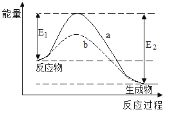
A.该反应为吸热反应
B.a与b相比,a的反应速率更快
C.a与b相比,反应的平衡常数一定不同
D.E2大于E1,说明总能量生成物比反应物低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com