
室温时,下列混合溶液的pH一定小于7的是( )
A.pH=3的盐酸和pH=11的氨水等体积混合
B.pH=3的盐酸和pH=11的氢氧化钡等体积混合
C.pH=3的醋酸和pH=11的氢氧化钡等体积混合
D.pH=3的硫酸和pH=11的氨水等体积混合
 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。

问题:
(1)装置A中盛放亚硫酸钠的仪器名称是 ,其中发生反应的化学方程式为 ;
(2)实验过程中,装置B、C中发生的现象分别是 、 ,这些现象分别说明SO2具有的性质是 和 ;装置B中发生反应的离子方程式为 ;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象 ;
(4)尾气可采用 溶液吸收。
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物A是农药生产中的一种中间体,结构简式如下图所示。下列叙述中正确的是( )
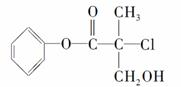
A.1 mol A最多能与4 mol H2发生加成反应 B.有机物A可以在一定条件下与HBr发生反应
C.有机物A与浓硫酸混合加热,可以发生消去反应
D.1 mol A与足量的NaOH溶液反应,最多可以消耗2 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
A. 常温下,0.1mol碳酸钠晶体中含有CO32-的个数为0.1 NA
B.标准状况下22.4 L H2O所含分子数为NA
C. 1L 0.5mol·L-1 CH3COOH溶液中,CH3COO-离子的个数为0.5NA
D. NO、NO2混合气体22.4L含有的氮原子数为NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
右图是恒温下某化学反应的反应速率随反应时间变化的示意图。下列叙述与示意图不相符合的是( )

A.反应达平衡时,正反应速率和逆反应速率相等
B.该反应达到平衡态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡态Ⅱ
C.该反应达到平衡态Ⅰ后,减小反应物浓度,平衡发生移动,达到平衡态Ⅱ
D.同一种反应物在平衡态Ⅰ和平衡态Ⅱ时浓度不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
按下图装置进行实验,并回答下列问题
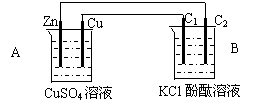 |
⑴锌极为__________极,电极反应式为_________________________
石墨棒C1为______极,电极反应式为________________________
石墨棒C2附近发生的实验现象为_______________________________
⑶当C2极析出224mL气体(标准状态)时,锌的质量减少_________g.
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液可能含有Na+、Fe2+、Br-、CO32-、I-、SO32-六种离子中的几种①在该溶液中加入足量氯水后,有气泡产生,溶液呈橙黄色;②向橙黄色的溶液中加入BaC12溶液时无沉淀生成;③向淀粉溶液中滴加该橙黄色溶液未变蓝色,则在该溶液中肯定存在的离子组是
A.Na+、SO32-、I- B.Na+、Br-、CO32-
C.Fe2+、I-、SO32- D.Fe2+、CO32-、Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
碳和氮的许多化合物在工农业生产和生活中有重要的作用。
28、工业上生产硝酸所需要的一氧化氮常用氨气来制备,该反应的化学方程式为
29、以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)→NH2CO2 NH4(s) +l59.5 kJ·mol-1
②NH2CO2NH4(s) →CO(NH2)2(s)+H2O(g) -116.5 kJ·mol-1
③H2O(1) →H2O(g) -44.0kJ·mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式
30、以氨气代替氢气研发氨燃料电池是当前科研的一个热点,已知氨燃料电池使用的电解质溶液是2mol·L-1的KOH溶液,电池反应为:4NH3+3O2=2N2+6H2O。每消耗3.4g NH3转移的电子数为 (阿伏加德罗常数的值用NA表示)。
31、用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g) ====N2(g)+CO2(g)+Q kJ·mol-1。
在T1℃时,反应进行到不同时间测得各物质的浓度如下:
| 时间(Min) 浓度(mol·L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①T1℃时,该反应的平衡常数K= ;
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 (填字母编号)。
a.加入一定量的活性炭 b.通人一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则Q 0(填 “>”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
用水处理金属钠与碳化钙的混合物,有气体放出,此气体在催化剂作用下恰好完全反
应,生成另一种气体A。气体A完全燃烧时,需要3.5倍体积的氧气,则金属钠与
碳化钙的物质的量之比是
A.2∶1 B.1∶2 C.4∶1 D.1∶4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com