
【题目】新能源的开发利用是人类社会可持续发展的必然选择。下列不属于新能源开发利用的是
|
|
|
|
A. 风力发电 | B. 锂电池供电 | C. 水力发电 | D. 太阳能供暖 |
A. A B. B C. C D. D
科目:高中化学 来源: 题型:
【题目】下列反应在常温下均为非自发反应,在高温下仍为非自发反应的是
A. Ag2O(s)===2Ag(s)+![]() O2(g)
O2(g)
B. Fe2O3(s)+![]() C(s)===2Fe(s)+
C(s)===2Fe(s)+![]() CO2(g)
CO2(g)
C. N2O4(g)===2NO2(g)
D. 6C(s)+6H2O(l)===C6H12O6(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图是可逆反应A+2B![]() 2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断
2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断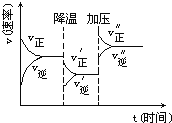
A. A、B、C、D均为气体
B. 若A、B是气体,则C、D是液体或固体
C. 温度越高,K越大
D. 在整个过程中,A的转化率一直增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)对于反应2SiHCl3(g)===SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。

①343 K时反应的平衡转化率α=________%。平衡常数K343 K=________(保留2位小数)。
②在343 K下:要提高SiHCl3转化率,可采取的措施是________;要缩短反应达到平衡的时间,可采取的措施有________、________。
③比较a、b处反应速率大小:va________vb(填“大于”“小于”或“等于”)。反应速率v=v正-v逆=k正x2SiHCl3-k逆xSiH2Cl2xSiCl4,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处的v正/v逆=________(保留1位小数)。
(2)不同温度下水的离子积常数如表所示:
t/℃ | 0 | 10 | 20 | 25 | 40 | 50 | 100 |
Kw/10-14 | 0.114 | 0.292 | 0.681 | 1.01 | 2.92 | 5.47 | 55.0 |
①请用文字解释随温度升高水的离子积增大的原因_______________;
②10℃时纯水的电离平衡常数为_________;计算100℃时纯水中电离产生的氢离子浓度为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤代烃在碱性醇溶液中能发生消去反应。例如,
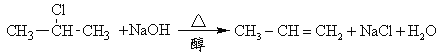
该反应式也可表示为
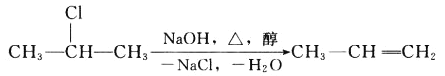
下面是几种有机化合物的转化关系:
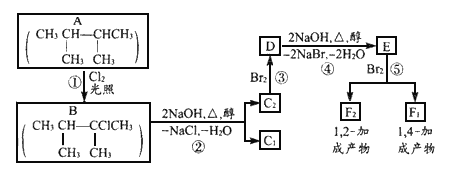
(1)根据系统命名法,化合物A的名称是_____________。
(2)写出下列反应的反应类型,①是_________③是___________。
(3)化合物E是重要的工业原料,写出由D生成E的化学方程式:_________。
(4)C2的结构简式是____________________________,F1的结构简式是______________,F1与F2互为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为发光二极管连接柠檬电池装置,下列说法正确的是
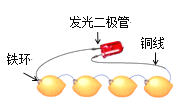
A. 铁环作为柠檬电池的正极
B. 电子由发光二极管经导线流向Fe环
C. 负极的电极反应为:Fe-2 e-===Fe2+
D. 可将柠檬替换成盛装酒精溶液的装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20mL0.1000mol·L-1氨水用0.1000mol·L-1的盐酸滴定,滴定曲线如图,下列说法正确的是( )
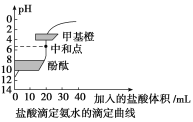
A.该中和滴定适宜用酚酞作指示剂
B.两者恰好中和时,溶液的pH=7
C.达到滴定终点时,溶液中:c(H+)=c(OH-)+c(NH3·H2O)
D.当滴入盐酸达30 mL时,溶液中c(NH4+)+c(H+)<c(OH-)+c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应原理在生产生活和科学研究中应用广泛。
(1)下列表述中没有氧化还原反应发生的是________。
a.滴水成冰 b.蜡炬成灰 c.百炼成钢
(2)NH3和Cl2反应的方程式为: NH3+ Cl2—N2+ HCl
①该反应中被氧化的元素是________(填元素名称),氧化剂是______(填化学式)。
②配平该方程式:NH3 + Cl2 — N2 + HCl __
③工业生产中常用喷洒氨水的方法来检查是否有Cl2泄漏,若Cl2有泄漏,可以观察到的现象是________,产生该现象的反应方程式为________。
(3)“地康法”制氯气的反应原理图示如下:

①反应I的化学方程式为________。
②反应II属于________反应。(填四种基本反应类型之一)。
③若要制得标准状况下氯气11.2L,则整个反应中转移电子的物质的量为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com