
 .
. 科目:高中化学 来源: 题型:实验题
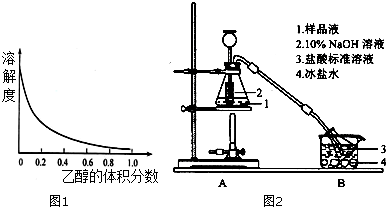
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
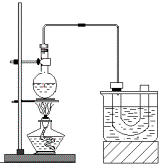 实验室制备溴乙烷(C2H5Br)的装置和步骤如图:(已知溴乙烷的沸点38.4℃)
实验室制备溴乙烷(C2H5Br)的装置和步骤如图:(已知溴乙烷的沸点38.4℃)查看答案和解析>>
科目:高中化学 来源: 题型:推断题
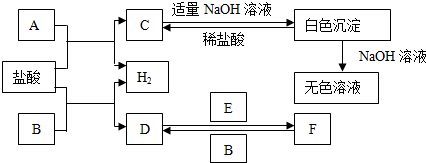
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
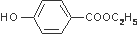 ,其生产过程如图所示(反应条件未全部注明):
,其生产过程如图所示(反应条件未全部注明):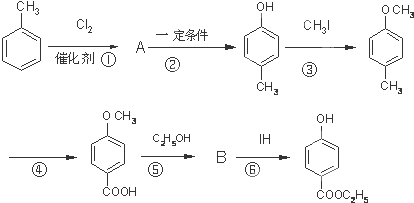
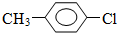 .
. +CH3I→
+CH3I→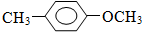 +HI
+HI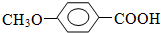 $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$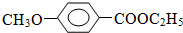 C2H5OH+H2O
C2H5OH+H2O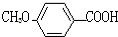 的同分异构体有多种,其中既含有酚羟基,又含有醇羟基和醛基的同分异构体共有13种,写出其中一种结构简式
的同分异构体有多种,其中既含有酚羟基,又含有醇羟基和醛基的同分异构体共有13种,写出其中一种结构简式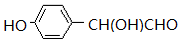 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
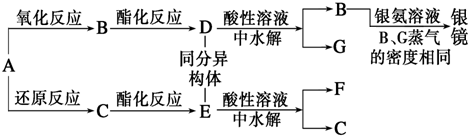
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,正确的是( )
,正确的是( )| A. | 3,3-二甲基-2-乙基戊烷 | B. | 3,3,4-三甲基己烷 | ||
| C. | 2-乙基-3,3-二甲基戊烷 | D. | 3,4,4-三甲基己烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com