
����Ŀ����1��ij�����ӵĽṹʾ��ͼ�ɱ�ʾΪ��

��x=8ʱ�������ӷ���Ϊ_______����x=11ʱ�������ӷ���Ϊ_______����x=13ʱ��д�������ӵ������εĻ�ѧʽΪ��__________��
��2����һ���¶��£���15g����ˮ������ˮ����ͭ��ĩ����ֽ��貢���ˣ��õ�һ����������ɫ��ˮ������ͭ�����8.4g��Һ�������¶�����ˮ����ͭ���ܽ��Ϊ40g�������ˮ����ͭ��������________��
��3����֪���ܵ�������һ�������¿�ת���ɸ����ܵ����ʡ��ڳ����Ȼ����������Թ��м���⻯����Һ����ɹ۲쵽��ɫ������Ϊ��ɫ��������д����Ӧ�Ļ�ѧ����ʽ���������ɡ�__________
���𰸡���1��Ne�� Na+��Al(NO3)3
��2��18.4g
��3��AgCl+KI=AgI��+KCl���⻯���ӳ������ŻӾ����֣����⻯�����Ȼ���������
�������������������1����x=8ʱ�����������������ں������������10��Ԫ����ԭ�ӣ������ӷ���ΪNe����x=11ʱ����11 ��Ԫ��Na�����ں����������10����������Naԭ��ʧȥ�����γɵ������ӣ������ӷ���ΪNa+����x=13ʱ��������Alԭ��ʧȥ3�������γɵ�Al3+������NO3-����һ����λ�ĸ���ɣ��������к���3����������ӣ������ӵ������εĻ�ѧʽΪ��Al(NO3)3��
��2����һ���¶��£���15g����ˮ������ˮ����ͭ��ĩ����ֽ��貢���ˣ��õ�һ����������ɫ��ˮ������ͭ�����8.4g��Һ����Һ�DZ�����Һ�����к��е�ˮ������(100��140)��8.4g=6g,��������ͭ������8.4g-6g=2.4g������������CuSO4��5H2O�����к���ˮ��������15g-6g=9g,�������ʻ�ѧʽCuSO4��5H2O��֪��160gCuSO4���90gH2O,��9gˮ��Ӧ��CuSO4��������16g������һ���������ˮ����ͭ��������16g+2.4g=18.4g��
��3����֪���ܵ�������һ�������¿�ת���ɸ����ܵ����ʡ��ڳ����Ȼ����������Թ��м���⻯����Һ����ɹ۲쵽��ɫ������Ϊ��ɫ�������÷�Ӧ�Ļ�ѧ����ʽ��AgCl+KI=AgI��+KCl����������ת����ԭ���ǵ⻯���ܽ�ȱ��Ȼ���С�����Ȼ��������ܣ����ܵ�������ܵ�ת����


 ���ٴ���������ѧϰ����ѧ�ں����ν�ϵ�д�
���ٴ���������ѧϰ����ѧ�ں����ν�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں��¡����Ϊ2L���ܱ������м���1molCO2��3molH2���������µķ�Ӧ��
CO2(g)+3H2(g)![]() CH3OH(g) +H2O(g) ��H��0��
CH3OH(g) +H2O(g) ��H��0��
���϶��ÿ��淴Ӧ��һ���������Ѵﵽ��ѧƽ��״̬���ǣ� ��
A��������CO2��H2��CH3OH��H2O�����ʵ���֮��Ϊ1��3��1 ��1
B��v��(CO2)��3v��(H2)
C�������ڻ������ƽ����Է����������ֲ���
D��������CO2��H2��CH3OH��H2O�����ʵ���Ũ�ȶ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʫ�������ϵ���˿����������ɻ���ʼ��������˿�����������ֱ����ڣ� ��
A. ��ά�ء���֬ B. �����ʡ�����
C. ���ۡ���֬ D. �����ʡ�Ӳ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���ʹpH=3��������pH=9��Ba(OH)2��Һ���ʹ���ΪpH=7����Һ�����ʱ�����Ba(OH)2��Һ�������Ϊ
A��1��60 B��3��1
C��1��100 D��100��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ݡ��칤������أ��ҹ��Ŵ���¯��ʯ(��Ҫ�ɷ���ZnCO3)��ұ����Ǧ(��п),��ԭ����ͼ2����֪п���۵�420�����е�906����������˵����������( )

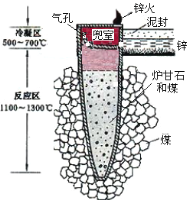
ͼ1 ͼ2
A�����������Ŀ����Ϊ�˷�ֹ�õ���п������
B����п������п������һ����̼�ڿ�����ȼ��
C��ұ��ʱп��Ϊ�����ڶ�������Ϊ����
D��������Ǧ���̰����ֽⷴӦ��������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�� �ڲ�ͬŨ��(c�����¶�(T��������,����ˮ���˲ʱ����(v�����±��������жϲ���ȷ������ ��

A��a=6.00
B��ͬʱ�ı䷴Ӧ�¶Ⱥ����ǵ�Ũ�ȣ�v���ܲ���
C��b��318.2
D���¶�Ϊbʱ������Ũ�ȼ���һ�������ʱ����318.2Kʱ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮAlCl3���������������л��ϳɵĴ����ȡ���ҵ����������(Al2O3��Fe2O3)Ϊԭ���Ʊ���ˮAlCl3�Ĺ����������¡�

��1���Ȼ�¯��Al2O3��Cl2��C��Ӧ�Ļ�ѧ����ʽΪ ��
��2����Na2SO3��Һ�ɳ�ȥ��ȴ���ų���β���е�Cl2���˷�Ӧ�����ӷ���ʽΪ ��
��3������������Ҫ����AlCl3��FeCl3�����������Al���������� ��
��4��Ϊ�ⶨ�Ƶõ���ˮAlCl3��Ʒ(������FeCl3)�Ĵ��ȣ���ȡ16.25 g��ˮAlCl3��Ʒ�����ڹ�����NaOH��Һ�У����˳�����������ᆳϴ�ӡ����ա���ȴ�����أ���������Ϊ0.32 g��
��д���������ӹ������漰�����ӷ���ʽ��
��AlCl3��Ʒ�Ĵ���Ϊ
��5����ҵ����һ��������Ϊԭ���Ʊ���ˮAlCl3�Ĺ����У����һ������AlCl3��6H2O��ˮ�Ʊ���ˮAlCl3��ʵ����һ���ķ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ˮ�е�NH4+���������£�

��1��������NH4+ת��ΪNO3-��NO2-����ҺpH__________�����������С���� �����䡱����
��2�����ݽ��µ��о���������ֻ��NO2-����ˮ�뺬NH4+����ˮ��������ϣ�ֱ��ת��Ϊ�����壬������Ϊ_________���˷������ŵ���__________��
��3����ȫ������1mol NH4+��ˮ����n(O2)��n(CH3OH)��ϵʽΪ___________[��n(O2)��n(CH3OH)��ʾ]��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1.12g���ۼ���25mL 2molL��1���Ȼ�����Һ�У���ַ�Ӧ�������ǣ� ��
A. ����ʣ�࣬��Һ��dz��ɫ��Cl��Ũ�Ȼ�������
B. ����Һ�е�����ɫKSCN��Һ���Ի�ɫ
C. Fe2+��Fe3+�����ʵ���֮��Ϊ6��1
D. ���������뻹ԭ��������ʵ���֮��Ϊ2��5
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com