
分析 (1)水的电离是吸热反应,升高温度促进水电离;该温度下,pH=12的NaOH溶液中c(NaOH)=c(OH-)=$\frac{1{0}^{-13}}{1{0}^{-12}}$mol/L=0.1mol/L,pH=1的稀硫酸中c(H+)=0.1mol/L,如果混合溶液pH=2,则混合溶液中c(H+)=0.01mol/L,c(H+)=$\frac{c({H}^{+})V({H}^{+})-c(O{H}^{-})V(O{H}^{-})}{V({H}^{+})+V(O{H}^{-})}$;
(2)如果在此溶液中加入等体积的pH为5的盐酸相当于稀释醋酸溶液,平衡正向进行;加入醋酸钠晶体,溶解后抑制电离,氢离子浓度减小,pH增大;
(3)Na2CO3为强碱弱酸盐,水解呈碱性,在溶液中存在CO32-+H2O?HCO3-+OH-,Na2CO3溶液中存在c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+);
(4)碳酸钠与强酸弱碱盐氯化铝发生双水解反应,以此来解答.
解答 解:(1)水的电离是吸热反应,升高温度促进水电离,t℃时水的离子积为1×10-13>1×10-14,则该温度大于25℃;
该温度下,pH=12的NaOH溶液中c(NaOH)=c(OH-)=$\frac{1{0}^{-13}}{1{0}^{-12}}$mol/L=0.1mol/L,pH=1的稀硫酸中c(H+)=0.1mol/L,如果混合溶液pH=2,则混合溶液中c(H+)=0.01mol/L,c(H+)=$\frac{c({H}^{+})V({H}^{+})-c(O{H}^{-})V(O{H}^{-})}{V({H}^{+})+V(O{H}^{-})}$=$\frac{0.1mol/L×bL-0.1mol/L×aL}{aL+bL}$=0.01mol/L,a:b=9:11,
故答案为:大于;9:11;
(2)已知25℃时0.1mol•L-1醋酸溶液达到平衡(CH3COOH?H++CH3COO-)时的pH约为3,如果在此溶液中加入等体积的pH为5的盐酸相当于稀释醋酸溶液,平衡正向进行;加入醋酸钠晶体,溶解后抑制电离,氢离子浓度减小,pH增大;
故答案为:向右;增大;
(3)Na2CO3为强碱弱酸盐,水解呈碱性,在溶液中存在CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,因CO32-水解水解显碱性,且第一步水解大于第一步电离,则离子浓度关系为:c(Na+)>c(CO32-)>c(OH-)>c (HCO3-);故答案为:c(Na+)>c(CO32-)>c(OH-)>c (HCO3-);
(4)碳酸钠与强酸弱碱盐氯化铝发生双水解反应,生成CO2灭火.即2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑
点评 本题考查了电离与水解方程式的书写,为高频考点,注意遵循电荷守恒和质量守恒定律,把握发生的化学反应及电解质的强弱及电离特点是解答的关键,题目难度中等.


 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:解答题
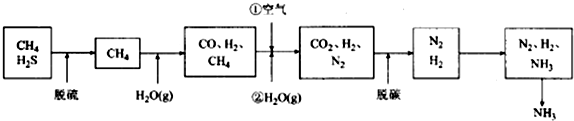
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 甲 | 乙 | 丙 | 丁 | |
| A | 2 | 1 | 2 | 1 |
| B | 1 | 1 | 2 | 2 |
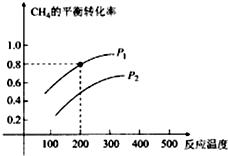
| A. | A的转化率为:甲<丙<乙<丁 | B. | A的转化率为:甲<乙<丙<丁 | ||
| C. | B的转化率为:甲>丙>乙>丁 | D. | B的转化率为:丁>乙>丙>甲 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸式滴定管在装酸液前未用待装液润洗2~3次,使测定结果偏大 | |
| B. | 滴定终点时,俯视读数,使测定结果偏小 | |
| C. | 只能选用酚酞作指示剂 | |
| D. | 滴入最后一滴NaOH溶液,溶液突然变色,即为滴定终点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入CO后,正反应速率逐渐增大 | |
| B. | 升高温度,H2S浓度增加,表明该反应是放热反应 | |
| C. | 反应前H2S物质的量为7mol | |
| D. | CO的平衡转化率为20% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 物质的 化学式 | NaOH(浓) | C2H5OH(酒精) | H2SO4 (浓) | NH4NO3 |
| 危险警 告标签 |  |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3通入AlCl3溶液中 | B. | Cu与硝酸反应 | ||
| C. | CO2通入NaOH溶液中 | D. | Na与O2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
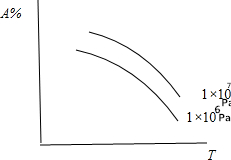
| A. | N2(气)+3H2(气)?2NH3(气);△H<0 | B. | C(固)+CO2(气)?2CO(气);△H>0 | ||
| C. | N2(气)十O2(气)?2N0(气);△H>0 | D. | CaCO3(固)?CaO(固)+CO2(气);△H>0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com